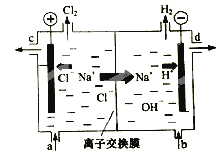
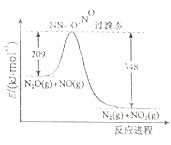
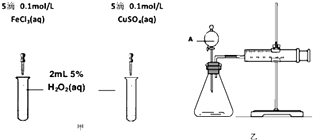
题目内容
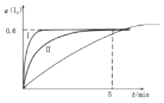
【题目】将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示 
(1)若改变反应条件,在某条件下a(I2)的变化如曲 线(I )所示,则该条件可能是:(填序号)
①恒容条件下,升高温度
②恒温条件下,缩小反应容器体积
③恒温条件下,扩大反应容器体积
④恒温、恒容条件下,加入适当催化剂
(2)该温度下此化学反应的化学平衡常数为 .
(3)在图基础上画出恒容条件下,降低温度,I2的转化率a(I2)随时间变化的曲线 .
(4)若在原平衡的基础上,保持体系温度不变,再往体系中通入1.4mol I2(g)和0.6mol HI(g),计算再次达到平衡时I2(g)的物质的量.(写出计算过程,已知最后结果保留2位有效数字)
【答案】
(1)②④
(2)2
(3)
(4)解:
H2(g)+ | I2(g) | 2HI(g) | |||
起始量: | 1.8 | 1.8 | 1.8 | ||
变化量: | x | x | 2x | ||
平衡浓度: | 1.8﹣x | 1.8﹣x | 1.8+2x |
所以K= ![]() ,解之得x=0.21,则:再次达到平衡时I2(g)的物质的量1.6mol,
,解之得x=0.21,则:再次达到平衡时I2(g)的物质的量1.6mol,
答:再次达到平衡时I2(g)的物质的量1.6mol.
【解析】解:(1)①恒容条件下,升高温度,反应速率加快,平衡向逆反应方向移动,所以碘的转化率减小,故错误;②恒温条件下,缩小反应容器体积,反应速率加快,达平衡所需时间缩短,但平衡不移动,所以碘的转化率不变,故正确;③恒温条件下,扩大反应容器体积,反应速率减小,达平衡所需时间增长,故错误;④恒温、恒容条件下,加入适当催化剂,反应速率加快,达平衡所需时间缩短,但平衡不移动,故正确;故选②④;
2)
H2(g)+ | I2(g) | 2HI(g) | |||
起始浓度: | 1.2 | 0.5 | 0 | ||
变化浓度: | 0.5×0.6 | 0.5×0.6 | 0.6 | ||
平衡浓度: | 0.9 | 0.2 | 0.6 |
所以K= ![]() =2,
=2,
所以答案是:2;(3)降低温度,达平衡的时间缩智囊,平衡正向移动,I2的转化率增大,所以图象为:  ,所以答案是:
,所以答案是: 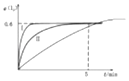 ;
;
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】对水样中溶质M的分解速率影响因素进行研究.在相同温度下,M的物质的量浓度(molL﹣1)随时间(min)变化的有关实验数据见表.下列说法不正确的是( )
时间 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.4 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.4 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Ca2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
A.在0~20 min内,Ⅰ中M的分解速率为0.015 molL﹣1min﹣1
B.水样酸性越强,M的分解速率越快
C.在0~20 min内,Ⅲ中M的分解百分率比Ⅱ大
D.由于Ca2+存在,Ⅳ中M的分解速率比Ⅰ快