题目内容
【题目】常温下,分别将四块形状相同、质量均为7 g的铁片同时放入下列四种溶液中,产生气体速率最快的是( )
A.150 mL 2 mol·L-1盐酸
B.500 mL2mol·L-1硫酸
C.50 mL 3 mol·L-1盐酸
D.50 mL 18.4 mol·L-1硫酸
【答案】B
【解析】18.4 mol·L-1的硫酸为浓硫酸,常温下,使铁发生钝化;2 mol·L-1的硫酸中c(H+)=4 mol·L-1,浓度最大,反应最快。
所以答案是:B

【题目】利用废碱渣(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,可制得无水Na2SO3(成品),其流程如图所示。
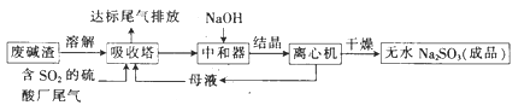
(1)某硫酸厂排放出的尾气中SO2的含量特别髙,而废碱渣的量不足,此时“吸收塔”内发生反应的离子方程式为_______________(不考虑H2O与SO2反应)。
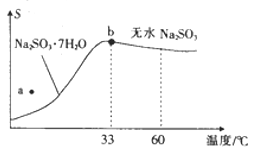
(2)亚硫酸钠的溶解度曲线如图所示,则上述流程中“结晶”的方法是___________(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为____________(填“浊液”“胶体”或“溶液”)。
(3)仅用BaCl2、H2O2和过量稀盐酸的混合溶液难以检出“成品”中的SO32-,原因是“成品”中含有某种杂质阴离子。
①该杂质阴离子为________________(填离子符号)。
②25℃时,部分钡盐的Ksp如下表所示。
化学式 | BaSO4 | BaSO3 |
Ksp | 1.1×10-10 | 5.5×10-7 |
将得到的“成品”溶于水,测得溶液中SO32-的浓度为0.5mol L-1,为杂质阴离子浓度的10倍,向该溶液中加入等体积、0.5mol·L-1的BaCl2溶液,充分反应后c(Ba2+)=_______mol L-1。(混合时溶液体积的变化忽略不计)
(4)某同学采用如下方法检验SO32-:
![]()
①洗涤时使用的试剂最好为____________(填字母)。
a.稀HNO3 b.蒸馏水 c.稀H2SO4
②根据上述流程中的数据(w、x、y)_____________ (填“能”或“不能”)计算出成品试样中SO32-的百分含量,若能,则SO32-的百分含量为 (若不能,则此空不填);若不能,则理由是_____________(若能,则此空不填)。
【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
A | CO2(HCl) | 饱和碳酸钠溶液 | 洗气 |
B | CO2(CO) | O2 | 点燃 |
C | CuSO4(FeSO4) | Cu | 过滤 |
D | NaCl(Na2CO3) | 盐酸 | 蒸发结晶 |
A.AB.BC.CD.D

