题目内容
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。
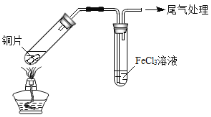
A B
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、 。
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
写出装置A中产生SO2的化学方程式: 。
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因(用化学用语解释): 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式: 。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
⑹综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
【答案】
(1)气密性 NaOH (2)100mL容量瓶
(3)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)H2O+SO2![]() H2SO3;H2SO3
H2SO3;H2SO3![]() H++HSO3-;
H++HSO3-;
Fe3++HSO3-![]() Fe(HSO3)2+
Fe(HSO3)2+
Fe3++H2O+Fe(HSO3)2+=2Fe2++SO42-+3H+
(5)加热或提高FeCl3溶液的酸性会缩短浅绿色出现的时间
【解析】
试题分析:(1)有气体参加的化学实验,实验前,应先检查装置的气密性;SO2是酸性氧化物,与碱反应,所以实验中产生的尾气应通入NaOH溶液 。
(2)配制溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、玻璃棒和100mL容量瓶。
(3)装置A中是铜和浓硫酸在加热的条件下发生反应生成硫酸铜、SO2和水,所以产生SO2的化学方程式为Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑+2H2O。
CuSO4 + SO2↑+2H2O。
(4)SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因为H2O + SO2![]() H2SO3 、H2SO3
H2SO3 、H2SO3 ![]() H++HSO3-、Fe3+ + HSO3-
H++HSO3-、Fe3+ + HSO3-![]() Fe(HSO3)2+;Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+,则溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式为Fe3+ + H2O + Fe(HSO3)2+ = 2Fe2+ + SO42- + 3H+。
Fe(HSO3)2+;Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+,则溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式为Fe3+ + H2O + Fe(HSO3)2+ = 2Fe2+ + SO42- + 3H+。
(5)通过实验得出结论为加热或提高FeCl3溶液的酸性会缩短浅绿色出现的时间。