题目内容
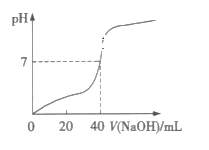
【题目】常温下,用1.0mol·L-1的NaOH溶液中和某浓度的H2SO4溶液,所得溶液的pH和所用NaOH溶液体积的关系如图所示,则原H2SO4溶液的物质的量浓度及完全反应后溶液的体积(忽略反应前后溶液体积的变化)分别是( )
A.1.0mol·L-1,20mLB.0.5mol·L-1,40mL
C.0.5mol·L-1,80mLD.1.0mol·L-1,80mL
【答案】C
【解析】
从图中可以看出,混合溶液pH=7时,消耗NaOH溶液的体积为40mL,则混合溶液的体积必定大于40mL。
A.由分析知,混合溶液的体积不可能为20mL,A不符合题意;
B.由分析知,混合溶液的体积不可能为40mL,B不符合题意;
C.混合溶液体积为80mL时,H2SO4溶液为40mL,若其浓度为0.5mol·L-1,则n(H+)=0.5mol·L-1×2×0.04L=0.04mol,n(OH-)=1.0mol·L-1×0.04L=0.04mol,酸碱刚好完全反应,C符合题意;
D.混合溶液体积为80mL时,H2SO4溶液为40mL,若其浓度为1.0mol·L-1,则n(H+)=1.0mol·L-1×2×0.04L=0.08mol,n(OH-)=1.0mol·L-1×0.04L=0.04mol,反应后酸过量,混合溶液的pH<7,D不合题意;
故选C。

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目