题目内容
重铬酸钾(K2Cr2O7)是常用的氧化剂,工业上以铬铁矿(含有Cr2O3、FeO、Al2O3、SiO2等)为原料制备重铬酸钾的流程如下。
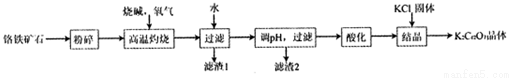
已知:NaFeO2遇水强烈水解。
请回答下列问题:
(1)将矿石粉碎的目的是_________。
(2)高温灼烧后产物中含有NaFeO2、Na2CrO4等成份,写出生成Na2CrO4的化学方程式____________。
(3)“滤渣1”中有红褐色物质,写出生成该物质的离子方程式______________。
(4)“滤渣2”中主要成分是A1(OH)3和 ___________。
(5)“酸化”反应的离子方程式为2CrO42-(aq)+2H+(aq) Cr2O72-(aq)+H2O。在25℃时,取Na2CrO4溶液进行酸化实验,测得部分实验数据如下:
Cr2O72-(aq)+H2O。在25℃时,取Na2CrO4溶液进行酸化实验,测得部分实验数据如下:

表格中b=__________;若反应达到平衡时,溶液的pH=1,则该反应的平衡常数K=__________;
(6)简要说明Na2CrO7溶液中加入KCl固体,“结品”析出K2Cr2O7晶体的原因_________________。
练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目


 Ka= 1.7×10—5 mol/L )可使溶液A和溶液B的PH相等的方法是
Ka= 1.7×10—5 mol/L )可使溶液A和溶液B的PH相等的方法是  正确的是 ( )
正确的是 ( ) 为2NA
为2NA