题目内容
10.下列叙述正确的是( )| A. | 由甲烷分子呈正四面体形结构可推知一氯甲烷分子也呈正四面体形结构 | |
| B. | 在甲烷的四种氯的取代物中,只有四氯甲烷是非极性分子 | |
| C. | 由甲烷(CH4)的氯代物有4种,可推知乙烷(结构式为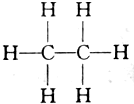 )的氯代物有6种 )的氯代物有6种 | |
| D. | 由于CH4是易燃易爆的气体,所以点燃CH4前一定要检验其纯度 |
分析 A.甲烷分子呈正四面体形结构,一氯甲烷分子中C-H、C-Cl键长不等,呈三角锥型结构;
B.正负电荷重心重合为非极性分子,正负电荷重心不重合为极性分子;
C.甲烷中只存在一种化学环境的H,故其有四种氯代物,乙烷除一氯代物外,二氯代物就存在同分异构体,多个氯原子可能在同一个碳上;
D.根据可燃性气体与空气混合后点燃可能发生爆炸,进行分析判断.
解答 解:A.甲烷分子是以碳原子为中心的正四面体结构,四个键完全相同,一氯甲烷分子,三个C-H键完全相同,但与C-Cl不同,所以呈三角锥型结构,故A错误;
B.甲烷分子呈正四面体形结构,四个C-H键完全相同,正负电荷重心重合为非极性分子,四氯甲烷四个C-Cl键完全相同,正负电荷重心重合为非极性分子,二氯甲烷、三氯甲烷C-H键与C-Cl不同,正负电荷重心不重合为极性分子,故B正确;
C.甲烷有四种氯代物,乙烷中由于取代1个H后,剩余5个H原子分为两种不同的H,故二氯代物就出现同分异构体,多个氯原子可能在同一个碳上或不同的碳上,乙烷的氯代物大于6种,故C错误;
D.可燃性气体与空气混合后点燃可能发生爆炸,为防止发生爆炸,点燃前一定要检验其纯度,所以点燃CH4前一定要检验其纯度,故D正确;
故选BD.
点评 本题考查了有机物的结构,掌握甲烷分子的空间构型是解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.今有A、B两种原子,B原子的电子总数比A原子的电子总数的两倍多一个,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是( )
| A. | Si和Al | B. | N和P | C. | F和Cl | D. | C和Al |
18.将100mL 0.1mol/L K2CO3溶液与pH=13的Ba(OH)2溶液等体积混合,要使其滤液的pH=7,应加入1mol/L盐酸的体积为( )
| A. | 10mL | B. | 20mL | C. | 40mL | D. | 60mL |
10.将11.2g铁粉投入40ml较浓的HNO3中,完全反应时收集到NO和NO2混合气体1792ml(标准状况),还残留5.6g固体.则原HNO3的物质的量浓度为( )
| A. | 3.5mol/l | B. | 4.5mol/l | C. | 7.0mol/l | D. | 9.0mol/l |




 .
.