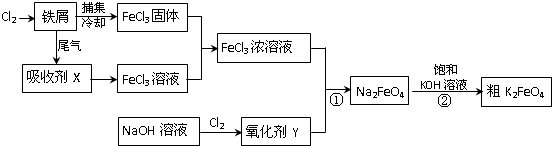
题目内容
5.已知拆开1mol H2,1mol O2中的化学键需要消耗的能量分别为436kJ、496kJ,形成1mol H-O键释放的能量为463kJ,试说明2mol H2(g)在适量O2中燃烧生成水蒸气的能量变化范围.分析 反应2H2(g)+O2(g)=2H2O(g)中,已知拆开1molH2、1molO2和1molH-O中的化学键分别需要消耗436KJ、496KJ和463KJ能量,反应的焓变△H=旧键断裂吸收的能量和新建生成释放的能量之差,据此计算.
解答 解:反应2H2(g)+O2(g)=2H2O(g)中,拆开1molH2、1molO2和1molH-O中的化学键分别需要消耗436KJ、496KJ和463KJ能量,反应的焓变△H=2×436KJ/mol+496KJ/mol-2×2×463KJ/mol=-484KJ/mol,说明2mol H2(g)在1molO2中燃烧生成2mol水蒸气会放出484kJ的能量,若氧气少于1moL,则放热更少,所以2mol H2(g)在适量O2中燃烧生成水蒸气的能量变化范围为Q≤484kJ,
答:2mol H2(g)在适量O2中燃烧生成水蒸气的能量变化范围为Q≤484kJ.
点评 本题考查了焓变计算应用,注意从键能的角度计算反应热的方法,题目较简单.

练习册系列答案
相关题目
16.吸烟对人体危害极大,香烟燃烧产生大量污染物,如表为某品牌香烟烟雾中各物质的含量.
(1)其中有害物质的含量大于(大于或小于)10%,尼古丁是无色油状液体,大量存在香烟烟雾中,说明其具有易挥发的性质;
(2)表中物质,能与血红蛋白结合的是CO,有芳香气味,常做溶剂但有致癌作用的烃是苯,既与酸雨的形成有关,也与光化学烟雾的形成有关的是NO2.
| 物质 | CO | CO2 | C2H6 | NOx | 焦油 | 尼古丁 | 甲醛 | 苯 |
| 含量 (mg/支) | 17 | 60 | 0.6 | 0.6 | 35 | 2.5 | 0.05 | 0.1 |
(2)表中物质,能与血红蛋白结合的是CO,有芳香气味,常做溶剂但有致癌作用的烃是苯,既与酸雨的形成有关,也与光化学烟雾的形成有关的是NO2.
10.下列叙述正确的是( )
| A. | 由甲烷分子呈正四面体形结构可推知一氯甲烷分子也呈正四面体形结构 | |
| B. | 在甲烷的四种氯的取代物中,只有四氯甲烷是非极性分子 | |
| C. | 由甲烷(CH4)的氯代物有4种,可推知乙烷(结构式为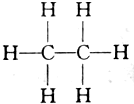 )的氯代物有6种 )的氯代物有6种 | |
| D. | 由于CH4是易燃易爆的气体,所以点燃CH4前一定要检验其纯度 |
4.合理利用某些盐能水解的性质,能解决许多生产、生活中的问题,下列叙述的事实与盐水解的性质无关的是( )
| A. | 金属焊接时可用NH4Cl溶液作除锈剂 | |
| B. | Al2(SO4)3与NaHCO3溶液可用作消防器材中的灭火剂 | |
| C. | 小苏打可用于治疗胃酸过多类疾病 | |
| D. | 向FeCl3溶液中加入CaCO3粉末后有气泡产生 |
5.分类法在化学科学中起着非常重要的作用,下列各组物质中,在物质分类里,前者属于后者的一组是( )
| A. | 金属,化合物 | B. | 单质,纯净物 | ||
| C. | 石灰乳,胶体 | D. | 过氧化钠,碱性氧化物 |