题目内容
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如下:
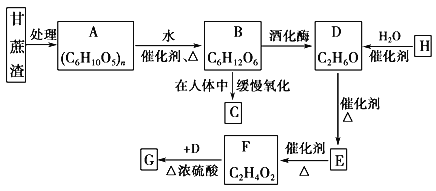
已知石油裂解已成为生产H的主要方法,E的溶液能发生银镜反应,G是具有香味的液体,试回答下列问题。
(1)F中所含官能团的名称是__________________。
(2)G的结构简式为_____________________________。
(3) 写出D→E的化学方程式,并注明反应类型:______________________________。
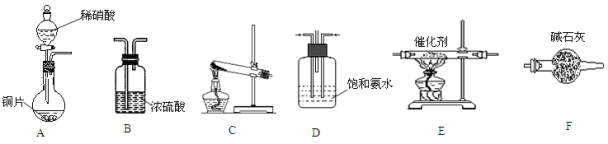
(4) F→G的反应装置如图所示:

a.图中倒置球形干燥管的作用_____________________________;
b.试管Ⅱ中加有饱和Na2CO3溶液,其作用是: ____________________;
c.若138 g D和90 g F反应能生成80 g G,则该反应的产率为___________。(已知:![]() )
)
(5)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ,再测有机物层的厚度,实验记录如下:
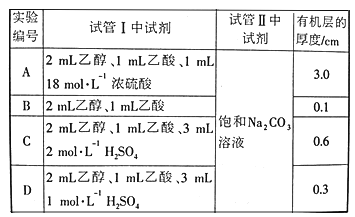
实验D与实验C相对照可证明___________________________________________________。
分析实验A、C的数据,可以推测出浓硫酸的__________提高了乙酸乙酯的产率。
(6) 生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)________。
①单位时间里,生成1 mol乙酸乙酯,同时生成1 mol水
②单位时间里,生成1 mol乙酸乙酯,同时生成1 mol乙酸
③单位时间里,消耗1 mol乙醇,同时消耗1 mol乙酸
④混合物中各物质的浓度不再变化
(7) 写出B的一种同分异构体(与B同类)的结构简式:________________。
【答案】 羧基 CH3COOC2H5或CH3COOCH2CH3 2CH3CH2OH + O2![]() 2CH3CHO +2H2O 氧化反应 防倒吸 溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度 60.6% c(H2SO4)越大,酯化反应进行的程度越大 吸水性 ②④ CH2OH(CHOH)3COCH2OH
2CH3CHO +2H2O 氧化反应 防倒吸 溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度 60.6% c(H2SO4)越大,酯化反应进行的程度越大 吸水性 ②④ CH2OH(CHOH)3COCH2OH
【解析】
甘蔗渣处理之后得到纤维素,纤维素水解的最终产物为葡萄糖,所以A是纤维素,B是葡萄糖,葡萄糖在酒化酶的作用下反应生成乙醇,则D是乙醇,D发生催化氧化生成E为CH3CHO,E进一步发生氧化反应生成F为CH3COOH,F与D发生酯化反应生成G为CH3COOCH2CH3,葡萄糖在人体内最终氧化得到二氧化碳与水。H与水反应达到乙醇,则H为CH2=CH2。
(1)F为CH3COOH,含有的官能团为羧基;
(2)G是由乙醇和乙酸发生酯化反应得到的乙酸乙酯,乙酸乙酯的结构简式为CH3COOC2H5或CH3COOCH2CH3;
(3)D是乙醇,乙醇催化氧化得到E(CH3CHO),此反应为氧化反应,反应方程式为2CH3CH2OH + O2![]() 2CH3CHO +2H2O;
2CH3CHO +2H2O;
(4)a.制取乙酸乙酯时,蒸汽中往往含有乙醇和乙酸,但是二者易溶于水而产生倒吸,所以图中倒置球形干燥管的作用;b.饱和碳酸钠溶液的作用主要有3个①使混入乙酸乙酯中的乙酸与Na2CO3反应而除去;②使混入的乙醇溶解;③使乙酸乙酯的溶解度减小,减少其损耗及有利于它的分层和提纯;c.138g乙醇的物质的量是138g÷46g/mol=3mol,90g乙酸的物质的量是90g÷60g/mol=1.5mol,由于乙醇过量所以反应产生的乙酸乙酯应该按照乙酸来计算,理论上应该产生乙酸乙酯的质量是1.5mol×88g/mol=132g。实际反应能生成80gE,则该反应的产率(80g÷132g)×100%=60.6%;
(5)实验D与实验C除硫酸浓度不同外,其他条件均相同,因此实验D与实验C相对照可证明c(H2SO4)越大,酯化反应进行的程度越大;对照实验A和C可以知道:试管Ⅰ中试剂实验A中使用1ml,18mol/L浓硫酸,生成的乙酸乙酯比C中生成的乙酸乙酯大很多,说明浓硫酸的吸水性提高了乙酸乙酯的产率。
(6)反应达到平衡状态标志是正逆反应速率相等,各物质的浓度、百分含量不变等;①任何情况下,每生成1 mol乙酸乙酯,都同时生成1 mol水,不能判定反应达到平衡。错误; ②单位时间里,生成1 mol乙酸乙酯,同时生成1 mol乙酸,表明正逆反应速率相等,因此能判定反应达到平衡。正确;③在任何情况下,消耗1 mol乙醇,同时消耗1 mol乙酸,不能判定反应达到平衡。错误;混合物中各物质的浓度不再变化,可以判定反应达到平衡。正确;故选②④。
(7)B为葡萄糖,结构简式为CH2OH—CHOH—CHOH—CHOH—CHOH—CHO。①与葡萄糖互为同分异构体②与B具有相同官能团,满足条件的同分异构体有:CH2OH(CHOH)3COCH2OH。

【题目】从煤化工行业中可以得到许多重要的工业资源。回答下列问题:
(1)从煤的气化获得的化工原料气中含有的少量羰基硫(COS)会引起催化制中毒,大气污染等问题。
①羰基硫与烧碱溶液反应生成两种正盐的离子方程式为_________________________________。
②羰基硫的脱硫方法之一为COS(g)+H2(g)=H2S(g)+ CO(g) ΔH=+7kJ·mol-1,已知反应中部分物质的键能数据如下:
化学键 | C=O | C=S | H-S | H-H |
键能(kJ·mol-1) | 745 | 577 | 339 | 436 |
则CO分子中的碳氧键的键能为_________________。
(2)羰基硫在高温下发生水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g)。T℃时,将0.30 molCOS(g)与0.50mol H2O(g)充入10L的恒容密闭容器中,30 s后反应达到平衡状态,此时H2S的物质的量分数为0.30。
H2S(g)+CO2(g)。T℃时,将0.30 molCOS(g)与0.50mol H2O(g)充入10L的恒容密闭容器中,30 s后反应达到平衡状态,此时H2S的物质的量分数为0.30。
①0~30 s内,COS的平均反应速率v(COS)=___________,该反应的平衡常数K=__________(保留3位有效数字)。
②向反应容器中再分别充入下列气体,能使COS的转化率增大的是_________(填字母)。
A.COS B.H2O C.H2S D.CO2
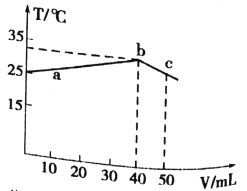
(3)将含H2S尾气的空气按一定流速通入酸性FeCl3溶液中,可实现含H2S尾气的空气脱硫。在FeCl3 溶液吸收H2S的过程中,溶液中的n(Fe3+)及被吸收的n(H2S)随时间t的变化如图所示。
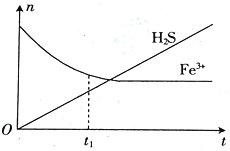
①由图中信息可知,0~t1时间段内,一定发生的反应是__________________________(用离子方程式表示)。
②t1时刻后,溶液中n(Fe3+)保持微量减少至基本不变,其原因是__________________________________。
【题目】下列实验中,对应的操作、现象及实验原理或结论均正确的是( )
实验目的 | 操作和现象 | 实验原理或结论 | |
A | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 向1mLlmol·L-1MgCl2溶液中滴加2滴2mol·L-1NaOH溶液,生成白色沉淀;再滴加2滴1mol·L-1'FeCl3溶液,白色沉淀变成红褐色沉淀 | 3Mg(OH)2(s)+2Fe3+(aq) |
B | 比较HClO和CH3COOH的酸性 | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 酸越弱,酸根离子水解程度越大,其盐溶液碱性越强 |
C | 提纯混有少量硝酸钾的氯化钠固体 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
D | 检验某溶液中是否含有SO42- | 向该溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
A. A B. B C. C D. D