题目内容
【题目】石油炼制过程中产生的大量H2S废气的处理设计方案如下图所示,下列说法不合理的是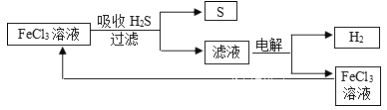
A. 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B. 电解过程中的阳极可发生的竞争反应主要为:2Cl--2e-=Cl2↑
C. 该工艺流程设计上处理废气H2S的同时也获得产品H2和S
D. 实验室可用点燃充分燃烧的方法消除H2S污染
【答案】D
【解析】A、由图中的流程图可知,FeCl3与H2S反应生成S和Fe2+,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,故A正确;B、电解的是氯化亚铁和盐酸溶液,阳极发生氧化反应,所得滤液中含有Fe2+、H+和Cl-,由于还原性Fe2+>Cl-(或根据图示循环),电解时阳极反应式为Fe2+-e-═Fe3+,可以发生的竞争反应为:2Cl--2e-=Cl2↑,故B正确;C、根据流程图,该过程中吸收的H2S最后转化为H2和S,故C正确;D、H2S充分燃烧的化学方程式为2H2S+3O2═2SO2+2H2O,生成的SO2也是一种有毒气体,生成了新的污染物,故D错误;故选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目