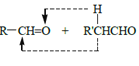
题目内容
【题目】下列离子方程式书写正确的是
A.向NH4HSO4溶液中滴加NaOH溶液至水的电离程度最大:2OH-+NH4++H+=NH3·H2O+H2O
B.硫酸型酸雨久置,pH减小:![]()
C.将Cl2通入少量FeBr2溶液中:2Fe2++Cl2=2Fe3++2Cl-
D.4mol·L-1的NaAlO2溶液和7mol·L-1的盐酸等体积混合:![]() +7H++H2O=3Al(OH)3↓+Al3+
+7H++H2O=3Al(OH)3↓+Al3+
【答案】D
【解析】
A.铵根的水解促进水的电离,硫酸氢根电离出的氢离子抑制水的电离,所以水的的电离程度最大时溶液中的溶质为(NH4)2SO4,离子方程式为OH-+H+=H2O,故A错误;
B.由于亚硫酸被空气中氧气氧化成硫酸,导致酸雨久置pH变小,亚硫酸为弱酸,所以离子方程式为:2H2SO3+O2=4H++2![]() ,故B错误;
,故B错误;
C.将Cl2通入少量FeBr2溶液中,此时氯气过量,会将Fe2+和Br-全部氧化,离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C错误;
D.4mol·L-1的NaAlO2溶液和7mol·L-1的盐酸等体积混合有足量的氢离子将偏铝酸根和氢离子反应生成氢氧化铝沉淀溶解,离子方程式为4![]() +7H++H2O=3Al(OH)3↓+Al3+,故D正确;
+7H++H2O=3Al(OH)3↓+Al3+,故D正确;
综上所述答案为D。

练习册系列答案
相关题目