题目内容
【题目】铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜![]() 铜绿
铜绿![]() ……
……![]() 铜”的转化。
铜”的转化。
铜![]() 铜绿
铜绿![]() A
A![]() Cu(OH)2
Cu(OH)2![]() B
B![]() Cu
Cu
(1)从三种不同分类标准回答,“铜绿”属于哪类物质?____。
(2)写出B的化学式____。
(3)上述转化过程中属于置换反应的是____(填序号)。
(4)写出①反应的化学方程式:_____。
【答案】铜盐、碳酸盐、碱式盐、盐、化合物(任意三种) CuO ⑤ 2Cu+O2+CO2+H2O=Cu2(OH)2CO3
【解析】
根据转化关系,铜![]() 铜绿
铜绿![]() A
A![]() Cu(OH)2
Cu(OH)2![]() B
B![]() Cu,铜被腐蚀生成铜绿,铜绿溶于盐酸生成铜盐,然后加碱生成氢氧化铜,氢氧化铜受热分解生成CuO,还原CuO得到Cu,据此分析解答。
Cu,铜被腐蚀生成铜绿,铜绿溶于盐酸生成铜盐,然后加碱生成氢氧化铜,氢氧化铜受热分解生成CuO,还原CuO得到Cu,据此分析解答。
(1)铜绿是碱式碳酸铜的俗称,属于化合物,也属于化合物中的盐类,含有铜元素,可以分为铜盐,含有碳酸根离子,可以为碳酸盐,含有氢氧根离子,也可以为碱式盐,故答案为:铜盐、碳酸盐、碱式盐、盐、化合物等;
(2)Cu(OH)2→B→Cu,是氢氧化铜受热分解生成氧化铜和水,氧化铜还原生成铜,因此B为氧化铜,故答案为:CuO;
(3)①为铜与二氧化碳氧气和水的化合反应,②为铜绿与酸发生的复分解反应,③为铜盐与碱的复分解反应,④为氢氧化铜的分解反应,⑤中还原剂氢气还原CuO得到 Cu, 属于置换反应,故答案为:⑤;
(4)①反应为Cu与氧气、二氧化碳、水发生化合反应生成Cu2(OH)2CO3,反应的化学方程式为:2Cu+O2+CO2+H2O═Cu2(OH)2CO3,故答案为:2Cu+O2+CO2+H2O═Cu2(OH)2CO3。

 阅读快车系列答案
阅读快车系列答案【题目】甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
反应II:CH3OH(g)+1/2O2(1)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
反应III:H2(g)+1/2O2(g)![]() H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
副反应:
反应IV:CH3OH(g)+O2(g)![]() CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
(1)计算反应Ⅱ的反应热△H2=____________________________________________。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
下图表示一定条件下温度对碳酸钠催化脱氢性能的影响,回答下列问题:
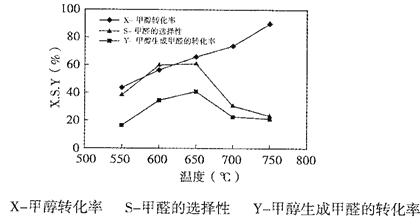
①从平衡角度解析550℃-650℃甲醇生成甲醛的转化率随温度升高的原因___________;
②反应历程i的活化能___________(填“>、“<”或“=”)CH3OH(g)![]() HCHO(g)+H2(g)活化能。
HCHO(g)+H2(g)活化能。
③650℃~750℃,反应历程ii的速率___________(填“>”、“<”或“=”)反应历程ⅲ的速率。
(4)吹脱是处理甲醛废水的一种工艺,吹脱速率可用方程v=0.0423c(mg·L-1·h-1)表示(其中c为甲醛浓度),下表为常温下甲醛的浓度随吹脱时间变化数据。
浓度(mg/L) | 10000 | 8000 | 4000 | 2000 | 1000 |
吹脱时间(h) | 0 | 7 | 23 | 39 | 55 |
则当甲醛浓度为2000mg/L时,其吹脱速率v=___________ mg·L-1·h-1,分析上表数据,起始浓度为10000mg/L,当甲醛浓度降为5000mg/L,吹脱时间为___________h。




