��Ŀ����
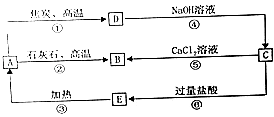
����Ŀ����ˮ�Ǿ����Դ���⣬��ˮ���ۺ����þ�����Ҫ���壨����ͼ��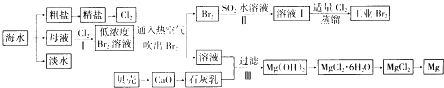
��1���ȼҵ��Ҫ��ʳ��Ϊԭ�ϣ�Ϊ�˳�ȥ�����е�Ca2+��Mg2+��SO42������ɳ���ɽ���������ˮ��Ȼ��������в������ټӹ�����NaOH��Һ���ڼӹ�����BaCl2��Һ�ۼӹ�����Na2CO3��Һ���ܹ��ˣ��ݼ����������ᣬ�ڢ۲�������Ŀ����
��2����ʵ���ҿ�������ȡ�ķ�����ȡ�壬����ȡ���������У�����˵������ȷ���� ��
A.��ȡ����ѡ�ñ���CCl4���ѻ����͵��л��ܼ���
B.��ȡ��Һʱ�²�Һ����¿ڷų����ϲ�Һ����Ͽڵ���
C.����ȡ�����У���Ҫ��Һ©��������Һ©���ϿڵIJ�����������
��3��ͨ���ȿ��������壬����SO2��ˮ��Һ���յ�Ŀ���� ��
��4����������������ữ�����Cl2�����ʵ�ԭ���� ��
��5����������йط�Ӧ�����ӷ���ʽ �� ���÷�Ӧ�ܹ�������ԭ�� ��
��6����ˮ������������У��¶�Ӧ������80��90�棬�¶ȹ�����Ͷ������������������ԭ�� ��
��7����ҵ�ϲ��õ������MgO�ƽ���þ�������� ��
���𰸡�
��1����ȥCa2+��������Ba2+����
��2��A
��3��������
��4���ữ������Cl2��Br2��ˮ��Ӧ
��5��Mg2+��aq��+Ca��OH��2��s��=Ca2+��aq��+Mg��OH��2��s������Ϊ����ͬ���¶��£�Mg��OH��2���ܽ�ȱ�Ca��OH��2��С
��6���¶ȹ��ߣ�����ˮ������ˮ�ų�����������ˮ���ӣ����¶ȹ��ͣ��岻����ȫ�����������ʵ�
��7��MgO�۵�ܸߣ�����ʱ���ܸߣ����������ɱ�
���������⣺��ˮɹ�κ�õ����Σ���ˮ�������ᴿ��ȥ��������Ca2+��Mg2+��SO42������ɳ���õ����Σ�����Ʊ�������ĸҺ����Ҫ�������Ӻ�þ���ӣ�ͨ����������������Ϊ�嵥�ʣ�������Ͷ�����������ͨ��ˮ�еõ�±ˮ��Һ���廯����Һ�������壬�������������廯��Ϊ�嵥�ʣ����Ȼ�þ����Һ�м��뱴�Ǹ��·ֽ����ɵ�����������ˮ���ɵ���������ʯ���飬����þ���ӣ����˺��ڳ����м��������ܽ⣬ͨ��Ũ����������ȴ�ᾧ����ϴ�ӵõ��Ȼ�þ���壬ʧˮ�õ��Ȼ�þ���壬���õ�þ����1��Ca2+��̼����ת��Ϊ������Mg2+��NaOHת��Ϊ������SO42�����Ȼ�����Һת��Ϊ�������ȳ�ȥMg2+��SO42�� �� Ȼ���ټ��������̼���Ƴ�ȥCa2+�Լ�������Ba2+���ʣ����˺��ټ������ȥ������NaOH��̼���ƣ����Դ��ǣ���ȥCa2+��������Ba2+���ʣ���2��A���ѻ����ͺ��в����ͼ��������巢���ӳɷ�Ӧ������������ȡ������A����B����ȡ��Һʱ�²�Һ����¿ڷų����ϲ�Һ����Ͽڵ�������ֹҺ�����»����Ⱦ����B��ȷ��C������ȡ�����У���Ҫ��Һ©�����Գ�ֻ�϶���ȡ������Һ©���ϿڵIJ�������������ֹ��Һ©���ڵ�ѹǿ����C��ȷ�����Դ��ǣ�A����3������I�Ѿ����Br2Ũ�Ƚϵͣ�Ӧ���и��������������Ӧ��õ�Ũ�ȽǶȵ��廯����Һ��Ȼ��ͨ�������ɵõ����壬��Ũ�����ᴿ��Ԫ�ص����ã�
���Դ��ǣ������壻��4������������ˮ��Ӧ���������HBr��Ϊ���淴Ӧ�����������ữ��������Cl2��Br2��ˮ��Ӧ�����Դ��ǣ��ữ������Cl2��Br2��ˮ��Ӧ����5��������þ���ܽ�ȱ���������С������Һ�м����������ƣ�������������þ��������Ӧ�����ӷ���ʽΪMg2+��aq��+Ca��OH�� 2��s��=Ca 2+��aq��+Mg ��OH�� 2��s�������Դ��ǣ�Mg2+��aq��+Ca��OH�� 2��s��=Ca 2+��aq��+Mg ��OH�� 2��s������Ϊ����ͬ���¶��£�Mg ��OH��2���ܽ�ȱ�Ca��OH��2��С����6������ˮ�У���ķе���58.5��C��ˮ����100��C���¶ȹ��ߣ�����ˮ������֮�ų���������ˮ�����ӣ��¶ȹ��ͣ��岻����ȫ���������ʵͣ�
���Դ��ǣ��¶ȹ��ߣ�����ˮ������ˮ�ų�����������ˮ���ӣ����¶ȹ��ͣ��岻����ȫ�����������ʵͣ���7��MgO�۵�ܸߣ������������þ��Ҫ���Ľϸߵ��������Ӷ����ӳɱ�����ҵ���õ�������Ȼ�þұ��Mg�����Դ��ǣ�MgO�۵�ܸߣ�����ʱ���ܸߣ����������ɱ���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����ҵ�������̿�MnCO3��[��FeCO3��SiO2��Cu2��OH��2CO3������]Ϊԭ����ȡ�������̣�������ʾ��ͼ���£� 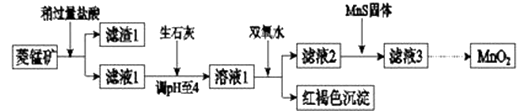
��֪�������������������pH
Mn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
��ʼ����ʱ | 8.3 | 6.3 | 2.7 | 4.7 |
��ȫ����ʱ | 9.8 | 8.3 | 3.7 | 6.7 |
ע���������ӵ���ʼŨ��Ϊ0.1mol/L���ش��������⣺
��1�������ʵ����̿�ʹ��ǰ�轫����飬��ҪĿ���� �� �����ܽ�MnCO3�Ļ�ѧ����ʽ�� ��
��2������Һ1�м���˫��ˮʱ����Ӧ�����ӷ���ʽ�� ��
��3����Һ2�м����Թ��������ܵ����MnS���Գ�ȥCu2+ �� ��Ӧ�����ӷ���ʽ�� ��
��4����MnCl2ת��ΪMnO2��һ�ַ���������������������������ữ��NaClO3��Һ��MnCl2�������÷�Ӧ�����ӷ���ʽΪ��Mn2++ClO3��+=++ ��
��5����MnCl2ת��ΪMnO2����һ�ַ����ǵ�ⷨ��
����������MnO2�ĵ缫��Ӧʽ�� ��
����ֱ�ӵ��MnCl2��Һ������MnO2��ͬʱ���������Cl2 �� ����Cl2�IJ����� ��
����������MnCl2��Һ�м���һ������Mn��NO3��2��ĩ������Cl2��������ԭ���� ��