题目内容
某探究性学习小组有查阅资料中发现,常温下氯气可以氧化氨气获得氮气.该小组由此设计出制取氮气的思路:
实验室现有如下试剂及仪器:(见图)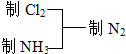
试剂:①饱和食盐水 ②浓硫酸 ③浓硝酸④浓盐酸 ⑤碱石灰 ⑥二氧化锰 ⑦浓氨水
请完成下列各题:
(1)写出制N2的化学方程式 ,反应生成0.5mol N2,转移的电子数是 mol.
(2)用以上仪器(可重复使用)连接成制纯净Cl2、NH3的装置,按照前后顺序把图中的编号填入下表中,并写出对应仪器里试剂的编号.(下列空格不一定填满)

(3)当反应装置里的氨气和氯气的物质的量之比大于 时,尾气里一定含有氨气;当反应装置里的氯气和氨气的物质的量之比大于 时,尾气里一定含有氯气.
实验室现有如下试剂及仪器:(见图)

试剂:①饱和食盐水 ②浓硫酸 ③浓硝酸④浓盐酸 ⑤碱石灰 ⑥二氧化锰 ⑦浓氨水
请完成下列各题:
(1)写出制N2的化学方程式
(2)用以上仪器(可重复使用)连接成制纯净Cl2、NH3的装置,按照前后顺序把图中的编号填入下表中,并写出对应仪器里试剂的编号.(下列空格不一定填满)

| 制Cl2 | 仪器 | |||
| 试剂 | ||||
| 制NH3 | 仪器 | |||
| 试剂 |
考点:常见气体制备原理及装置选择
专题:实验题,卤族元素,氮族元素
分析:(1)氯气和氨气发生氧化还原反应,N元素化合价升高,被氧化,氯元素的化合价降低,被还原,依据氧化还原书写方程式,由元素化合价可知,3molCl2参加反应,得到6mol电子,依据反应的电子转移守恒2NH3~N2~6e-;
(2)实验室用MnO2与浓盐酸共热制Cl2,根据制取气体的药品和条件来选择仪器和装置.氯气制备是固体和液体加热制备气体,氯气中含有氯化氢和水蒸气,可以通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;碱石灰的主要成分有氧化钙,实验室可用碱石灰与浓氨水混合的方法制取氨气,无需加热;氨气属于碱性气体,可以用碱性或中性物质干燥;
(3)根据2NH3+3Cl2=6HCl+N2,NH3+HCl=NH4Cl 进行分析解答;
(2)实验室用MnO2与浓盐酸共热制Cl2,根据制取气体的药品和条件来选择仪器和装置.氯气制备是固体和液体加热制备气体,氯气中含有氯化氢和水蒸气,可以通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;碱石灰的主要成分有氧化钙,实验室可用碱石灰与浓氨水混合的方法制取氨气,无需加热;氨气属于碱性气体,可以用碱性或中性物质干燥;
(3)根据2NH3+3Cl2=6HCl+N2,NH3+HCl=NH4Cl 进行分析解答;
解答:
解:(1)氯气和氨气发生氧化还原反应,Cl元素的化合价降低,化合价降低元素所在的反应物是氧化剂,则氧化剂为Cl2,N元素的化合价升高,化合价升高元素所在的反应物是还原剂,还原剂是NH3,由反应可知3mol氧化剂氯气与2mol还原剂氨气反应电子守恒,则氧化剂与还原剂的物质的量之比为3:2,反应为:3Cl2+2NH3═6HCl+N2,当氨气过量发生:HCl+NH3=NH4Cl,即:3Cl2+8NH3=6NH4Cl+N2,反应3Cl2+8NH3=6NH4Cl+N2中,3Cl2~6Cl-~6e-,2NH3~N2~6e-,生成1mol氮气转移电子6mol,则生成0.5mol N2,转移的电子数是3mol,
故答案为:2NH2+3Cl2=6HCl+N2 (或8NH2+3Cl2=6NH4Cl+N2);3;
(2)制Cl2装置A中反应是实验室制备氯气的装置,二氧化锰和浓盐酸加热反应制备氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,浓盐酸具有挥发性,加热更促进了浓盐酸的挥发,所以制取的氯气中含有氯化氢气体,氯化氢极易溶于水,氯气和水也反应,所以不能用水吸收氯化氢气体;饱和食盐水中含有氯离子,所以能抑制氯气和水的反应降低氯气的溶解度,故D中盛有的液体是饱和食盐水,通过浓硫酸除去水蒸气,再用洗气瓶D盛放浓硫酸除去水蒸气,根据提供的药品,制取氨气需选择装置C(或A),用碱石灰与浓氨水混合的方法制取氨气,无需加热,所以选择药品为⑤⑦(或⑦),仅选⑦需在A中加热,氨气属于碱性气体,可以用碱石灰干燥⑤,
故答案为:
(3)2NH3+3Cl2=6HCl+N2,
2 3 6 1
当
≥
时,氨气过量,发生HCl+NH3=NH4Cl,即:3Cl2+8NH3=6NH4Cl+N2,所以当
≥
时,氨气过量有剩余,尾气里一定含有氨气;
当<0
≤
时,仅发生2NH3+3Cl2=6HCl+N2,氯气过量有剩余,尾气里一定含有氯气;
故答案为:
;
;
故答案为:2NH2+3Cl2=6HCl+N2 (或8NH2+3Cl2=6NH4Cl+N2);3;
(2)制Cl2装置A中反应是实验室制备氯气的装置,二氧化锰和浓盐酸加热反应制备氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)
| ||
故答案为:
| 制Cl2 | 仪器 | A | D | D |
| 药品 | ④⑥ | ① | ② | |
| 制NH3 | 仪器 | C(或A) | E | |
| 药品 | ⑤⑦(或⑦) | ⑤ |
2 3 6 1
当
| n(NH3) |
| n(Cl2) |
| 2 |
| 3 |
| n(NH3) |
| n(Cl2) |
| 8 |
| 3 |
当<0
| n(NH3) |
| n(Cl2) |
| 2 |
| 3 |
故答案为:
| 8 |
| 3 |
| 2 |
| 3 |
点评:本题主要考查了氮气的制取,解答须根据题目中提供的药品和装置结合该反应的原理和相关物质的性质,题目难度中等.

练习册系列答案
相关题目
下列化学方程式或离子方程式正确的是( )
A、铁在少量氯气中燃烧:Fe+Cl2
| ||||
B、用两个铜电极电解食盐水:2Cl-+2H2O
| ||||
| C、亚硫酸钠固体溶于水:SO32-+H2O?HSO3-+OH- | ||||
| D、K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
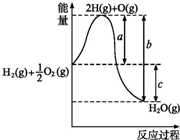
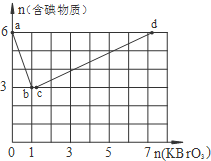 在稀硫酸酸化的含6mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图.请回答下列问题:
在稀硫酸酸化的含6mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图.请回答下列问题: :
: :
:
 :
: