题目内容
Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+=2Fe2++I2(水溶液).正向反应速率和I-、Fe3+的浓度关系为υ=k[I-]m[Fe3+]n (k为常数)
通过所给数据计算得知:
(1)在υ=k[I-]m[Fe3+]n中,m、n的值为 .[选填A、B、C、D]
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
(2)碘离子浓度对反应速率的影响 铁离子浓度对反应速率的影响.(选填:小于、大于、等于)
| [I-](mol?L-1) | [Fe3+]( mol?L-1) | υ(mol?L-1?s-1) | |
| (1) | 0.20 | 0.80 | 0.032k |
| (2) | 0.60 | 0.40 | 0.144k |
| (3) | 0.80 | 0.20 | 0.128k |
(1)在υ=k[I-]m[Fe3+]n中,m、n的值为
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
(2)碘离子浓度对反应速率的影响
考点:反应速率的定量表示方法,化学反应速率的影响因素
专题:化学反应速率专题
分析:(1)将表中的三组数据代入公式v=k[c(I-)]m?[c(Fe3+)]n得m和n的值;
(2)根据m与n的大小进行判断.
(2)根据m与n的大小进行判断.
解答:
解:(1)将表中的三组数据代入公式v=k[c(I-)]m?[c(Fe3+)]n,可得:
0.20m×0.80n=0.032K,
0.60m×0.40n=0.144K,
0.80m×0.20n=0.128K,
解得:m=2,n=1,
故答案为:C;
(2)已知m=2,n=1,故碘离子浓度对反应速率的影响大于铁离子浓度对反应速率的影响,
故答案为:大于.
0.20m×0.80n=0.032K,
0.60m×0.40n=0.144K,
0.80m×0.20n=0.128K,
解得:m=2,n=1,
故答案为:C;
(2)已知m=2,n=1,故碘离子浓度对反应速率的影响大于铁离子浓度对反应速率的影响,
故答案为:大于.
点评:本题考查化学反应速率的定量表示,难度不大,注意对信息的理解运用,重点考查学生自学能力与数据处理能力.

练习册系列答案
相关题目
下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是( )
| A、氧化钠和二氧化碳 |
| B、盐酸和碳酸钠 |
| C、氢氧化钠和二氧化碳 |
| D、碳和氧气 |
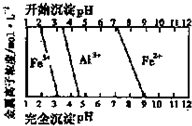 氧化铁在工业上具有广泛的应用.
氧化铁在工业上具有广泛的应用.


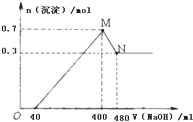 (1)将7.8克过氧化钠投入到100克10%的苛性钠溶液中充分反应.反应的离子方程式为:
(1)将7.8克过氧化钠投入到100克10%的苛性钠溶液中充分反应.反应的离子方程式为: