题目内容
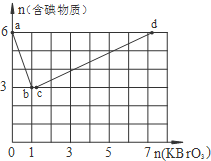 在稀硫酸酸化的含6mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图.请回答下列问题:
在稀硫酸酸化的含6mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图.请回答下列问题:(1)b点时,对应含碘物质的化学式为
(2)b→c过程中,仅有一种元素发生化合价变化,写出该反应的化学方程式
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的化学式为
(4)酸性条件下,Br2、IO3-、BrO3-、I2氧化性由强到弱的顺序为
(5)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡.则实验过程中的可能观察到的现象为
考点:氧化还原反应的计算
专题:计算题
分析:(1)b点时,KI反应完全,n(KI):n(KBrO3)=6:1,反应中KI被氧化,KBrO3被还原;
(2)b→c过程中,含碘物质的物质的量没有发生变化,溶液中存在Br-和BrO3-,二者发生氧化还原反应;
(3)n(KBrO3)=4时,溶液中含碘物质的物质的量介于3~6之间,部分I2被氧化生成KIO3;
(4)①BrO3-+6I-+6H+=3I2+Br-+3H2O、②2BrO3-+I2=2IO3-+Br2、③IO3-+5I-+6H+=3I2+3H2O、④2IO3-+10Br-+12H+=I2+5Br2+6H2O,氧化剂的氧化性大于氧化产物的氧化性;
(5)KBrO3能将KI氧化成KIO3,然后再与KI反应生成碘单质,以此分析现象.
(2)b→c过程中,含碘物质的物质的量没有发生变化,溶液中存在Br-和BrO3-,二者发生氧化还原反应;
(3)n(KBrO3)=4时,溶液中含碘物质的物质的量介于3~6之间,部分I2被氧化生成KIO3;
(4)①BrO3-+6I-+6H+=3I2+Br-+3H2O、②2BrO3-+I2=2IO3-+Br2、③IO3-+5I-+6H+=3I2+3H2O、④2IO3-+10Br-+12H+=I2+5Br2+6H2O,氧化剂的氧化性大于氧化产物的氧化性;
(5)KBrO3能将KI氧化成KIO3,然后再与KI反应生成碘单质,以此分析现象.
解答:
解:(1)b点时,KI反应完全,n(KI):n(KBrO3)=6:1,反应中KI被氧化,KBrO3被还原,反应的方程式为6I-+BrO3-+6H+=3I2+Br-+3H2O,对应含碘物质的化学式为I2,故答案为:I2;
(2)b→c过程中,含碘物质的物质的量没有发生变化,溶液中存在Br-和BrO3-,二者发生氧化还原反应,反应为KBrO3+5KBr+6H2SO4=3Br2+3H2O+3K2SO4,
故答案为:KBrO3+5KBr+6H2SO4=3Br2+3H2O+3K2SO4;
(3)n(KBrO3)=4时,溶液中含碘物质的物质的量介于3~6之间,部分I2被氧化生成KIO3,故答案为:KIO3 和I2;
(4)①BrO3-+6I-+6H+=3I2+Br-+3H2O、②2BrO3-+I2=2IO3-+Br2、③IO3-+5I-+6H+=3I2+3H2O、④2IO3-+10Br-+12H+=I2+5Br2+6H2O,则由反应①可知,氧化性BrO3->I2,由反应②可知,氧化性BrO3->IO3-,由反应③可知,氧化性IO3->I2,由反应④可知,氧化性IO3->Br2,故氧化性为BrO3->IO3->Br2>I2,
故答案为:BrO3->IO3->Br2>I2;
(5)KBrO3能将KI氧化成KIO3,然后再与KI反应生成碘单质,则在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡,观察到的现象为溶液先无色,后变蓝色,故答案为:溶液先无色,后变蓝色.
(2)b→c过程中,含碘物质的物质的量没有发生变化,溶液中存在Br-和BrO3-,二者发生氧化还原反应,反应为KBrO3+5KBr+6H2SO4=3Br2+3H2O+3K2SO4,
故答案为:KBrO3+5KBr+6H2SO4=3Br2+3H2O+3K2SO4;
(3)n(KBrO3)=4时,溶液中含碘物质的物质的量介于3~6之间,部分I2被氧化生成KIO3,故答案为:KIO3 和I2;
(4)①BrO3-+6I-+6H+=3I2+Br-+3H2O、②2BrO3-+I2=2IO3-+Br2、③IO3-+5I-+6H+=3I2+3H2O、④2IO3-+10Br-+12H+=I2+5Br2+6H2O,则由反应①可知,氧化性BrO3->I2,由反应②可知,氧化性BrO3->IO3-,由反应③可知,氧化性IO3->I2,由反应④可知,氧化性IO3->Br2,故氧化性为BrO3->IO3->Br2>I2,
故答案为:BrO3->IO3->Br2>I2;
(5)KBrO3能将KI氧化成KIO3,然后再与KI反应生成碘单质,则在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡,观察到的现象为溶液先无色,后变蓝色,故答案为:溶液先无色,后变蓝色.
点评:本题综合考查氧化还原反应,为高频考点,侧重于考查学生的数据分析能力和综合运用化学知识的能力,题目难度不大,注意图象中数目的关系.

练习册系列答案
相关题目
下列体系的熵变大于零的是( )
| A、水蒸气冷凝成水 |
| B、CaCO3(s)=CaO(s)+CO2(g) |
| C、乙烯聚合成聚乙稀 |
| D、N2O4(g)=2NO2(g) |
 氧化铁在工业上具有广泛的应用.
氧化铁在工业上具有广泛的应用.