题目内容
已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1molHI需要 (填“放出”或“吸收”)kJ的热量.
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答:
解:在反应H2+I2?2HI中,断裂1molH-H键、1molI-I键共吸收的能量为:1×436kJ+151kJ=587kJ,
生成2molHI,共形成2molH-I键,放出的能量为:2×299kJ=598kJ,
吸收的能量<放出的能量,则该反应为放热反应,放出的热量为:598kJ-587kJ=11kJ,
所以由氢气和碘反应生成1molHI需要放出的热量为:
kJ=5.5kJ,
故答案为:放出;5.5.
生成2molHI,共形成2molH-I键,放出的能量为:2×299kJ=598kJ,
吸收的能量<放出的能量,则该反应为放热反应,放出的热量为:598kJ-587kJ=11kJ,
所以由氢气和碘反应生成1molHI需要放出的热量为:
| 11 |
| 2 |
故答案为:放出;5.5.
点评:本题考查了有关反应热的计算,题目难度不大,注意掌握化学反应与能量变化的关系,明确从化学键断裂与生成的角度分析吸热、放热反应的方法.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
当0.2mol Na218O2与足量CO2完全反应后所得固体的质量为( )
| A、21.2g |
| B、21.6g |
| C、22.0g |
| D、22.4g |
质量相同的下列醇分别与过量的钠作用放出氢气最多的是( )
| A、甲醇 | B、乙醇 |
| C、乙二醇 | D、丙三醇 |


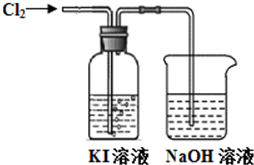 某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:
某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下: