题目内容
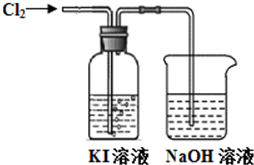 某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:
某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:通入氯气一段时间,KI溶液变为黄色.继续通入氯气一段时间后,溶液黄色褪去,变为无色.继续通入氯气,最后溶液变为浅黄绿色.
(1)已知I2+I-?I3-,I2、I3-在水中均呈黄色.为确定黄色溶液的成分,进行了以下实验.
| 操作 | 实验现象 | |
| a | 取2~3mL黄色溶液,加入足量CCl4,振荡静置. | CCl4层呈紫红色,水层显浅黄色. |
| b | 取2~3mL饱和碘水,加入足量CCl4,振荡静置. | CCl4层呈紫红色,水层几近无色. |
②根据实验a中,水层中含有的粒子有
③实验a中水溶液颜色变浅的原因是
④为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为
(2)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化.已知1mol Cl2可氧化0.2mol I2,该反应的化学方程式是
(3)根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为
考点:性质实验方案的设计
专题:卤族元素
分析:(1)氯气与KI发生Cl2+2I-=I2+2Cl-,以及I2+I-?I3-,取2~3mL黄色溶液,加入足量CCl4,振荡静置,CCl4层呈紫红色,水层显浅黄色,可说明溶液中存在I2、I3-;
(2)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化.1mol Cl2可氧化0.2mol I2,说明I元素化合价升高5价,应生成HIO3;
(3)向淀粉-KI溶液中持续通入氯气,先生成氯气,溶液变成蓝色,继续通入氯气,碘被氧化生成HIO3,溶液褪色.
(2)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化.1mol Cl2可氧化0.2mol I2,说明I元素化合价升高5价,应生成HIO3;
(3)向淀粉-KI溶液中持续通入氯气,先生成氯气,溶液变成蓝色,继续通入氯气,碘被氧化生成HIO3,溶液褪色.
解答:
解:(1)①实验b可用与对比实验,可证明a中溶液存在I3-,说明存在I2+I-?I3-平衡,不是单一的I2浓度降低所导致的;
故答案为:对比实验,证明实验a中水层显浅黄色是因为存在I2+I-?I3-平衡,不是单一的I2浓度降低所导致的;
②存在I2+I-?I3-平衡,则溶液中存在I2、I-、I3-,另外还含有Cl-、K+,故答案为:I2、I-、I3-、Cl-、K+;
③存在I2+I-?I3-平衡,溶液中存在I2,加入四氯化碳,碘易溶于四氯化碳,溶液中碘浓度降低,则I2+I-?I3-平衡逆向向移动,I3-浓度也降低,导致水溶液颜色变浅,
故答案为:由于萃取使水溶液中I2浓度降低,同时I2+I-?I3-平衡逆向向移动,I3-浓度也降低,导致水溶液颜色变浅;
④为保证实验的严谨性,在实验a、b的基础上,可取2~3 mL KI溶液,滴加少量的氯水(或通入少量氯气,或加入少量碘单质),再加入足量CCl4,振荡静置,观察到水层是否为黄色,或取少量实验a的水层溶液滴加AgNO3溶液,观察是否有黄色沉淀生成.或取少量实验a的水层溶液淀粉溶液,观察是否变蓝,
故答案为:取2~3 mL KI溶液,滴加少量的氯水(或通入少量氯气,或加入少量碘单质),再加入足量CCl4,振荡静置,观察到水层是否为黄色,
[或取少量实验a的水层溶液滴加AgNO3溶液,观察是否有黄色沉淀生成.或取少量实验a的水层溶液淀粉溶液,观察是否变蓝];
(2)氧化性Cl2>I2,KI溶液中通入氯气发生Cl2+2KI=KCl+I2,溶液变成黄色,继续通入氯气,发生5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:I2+5Cl2+6H2O=10HCl+2HIO3;
(3)继续通入氯气,碘被氧化生成HIO3,溶液褪色,故答案为:溶液先变蓝后褪色.
故答案为:对比实验,证明实验a中水层显浅黄色是因为存在I2+I-?I3-平衡,不是单一的I2浓度降低所导致的;
②存在I2+I-?I3-平衡,则溶液中存在I2、I-、I3-,另外还含有Cl-、K+,故答案为:I2、I-、I3-、Cl-、K+;
③存在I2+I-?I3-平衡,溶液中存在I2,加入四氯化碳,碘易溶于四氯化碳,溶液中碘浓度降低,则I2+I-?I3-平衡逆向向移动,I3-浓度也降低,导致水溶液颜色变浅,
故答案为:由于萃取使水溶液中I2浓度降低,同时I2+I-?I3-平衡逆向向移动,I3-浓度也降低,导致水溶液颜色变浅;
④为保证实验的严谨性,在实验a、b的基础上,可取2~3 mL KI溶液,滴加少量的氯水(或通入少量氯气,或加入少量碘单质),再加入足量CCl4,振荡静置,观察到水层是否为黄色,或取少量实验a的水层溶液滴加AgNO3溶液,观察是否有黄色沉淀生成.或取少量实验a的水层溶液淀粉溶液,观察是否变蓝,
故答案为:取2~3 mL KI溶液,滴加少量的氯水(或通入少量氯气,或加入少量碘单质),再加入足量CCl4,振荡静置,观察到水层是否为黄色,
[或取少量实验a的水层溶液滴加AgNO3溶液,观察是否有黄色沉淀生成.或取少量实验a的水层溶液淀粉溶液,观察是否变蓝];
(2)氧化性Cl2>I2,KI溶液中通入氯气发生Cl2+2KI=KCl+I2,溶液变成黄色,继续通入氯气,发生5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:I2+5Cl2+6H2O=10HCl+2HIO3;
(3)继续通入氯气,碘被氧化生成HIO3,溶液褪色,故答案为:溶液先变蓝后褪色.
点评:本题考查氯气与碘反应的性质,为高频考点,侧重于学生的分析能力实验能力的考查,难度不大,注意相关知识的积累.

练习册系列答案
相关题目
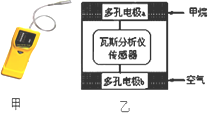 有一种瓦斯分析仪(如图甲),工作原理类似燃料电池,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
有一种瓦斯分析仪(如图甲),工作原理类似燃料电池,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )| A、瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| B、电极b是正极,O2-由电极a流向电极b |
| C、电极a的反应式为:CH4+5O2--8e-═CO32-+2H2O |
| D、当固体电解质中有1mol O2-通过时,电子转移4mol |
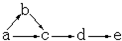 a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:
a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化: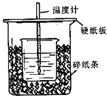 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: