题目内容
【题目】将0.56克KOH和1.38克K2CO3混合并配成溶液,向溶液中滴加0.1molL-1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. 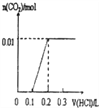 B.
B.  C.
C. 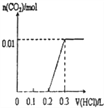 D.
D. 
【答案】C
【解析】根据物质的量的计算公式,0.56gKOH的物质的量是![]() =0.01mol,1.38g K2CO3的物质的量是
=0.01mol,1.38g K2CO3的物质的量是![]() = 0.01mol,KOH和K2CO3混合配成的溶液,滴加盐酸时,先发生KOH与HCl的反应,即KOH+HCl=KCl+H2O,再发生K2CO3和HCl反应生成KHCO3和KCl,最后发生碳酸氢钾与盐酸的反应才有CO2气体生成。
= 0.01mol,KOH和K2CO3混合配成的溶液,滴加盐酸时,先发生KOH与HCl的反应,即KOH+HCl=KCl+H2O,再发生K2CO3和HCl反应生成KHCO3和KCl,最后发生碳酸氢钾与盐酸的反应才有CO2气体生成。
当加入0.1LHCl时,n(HCl)= 0.1L×0.1mol/L = 0.01mol,根据KOH+HCl=KCl+H2O可知,此时0.01mol的KOH和0.01mol的HCl恰好完全反应,无气体生成,当再加入0.1L的HCl时,与0.01mol K2CO3的恰好完全反应生成KHCO3,也无气体生成,即当加入HCl共0.2L时,一直没有CO2气体生成,所以A、B、D三个图像均错误,答案选C。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目

