题目内容
向100 mL pH = l的H2SO4溶液中,滴加0.01 mol•L-1 NaOH溶液,当所得混合液的pH为2时,加入NaOH溶液的体积是( )
A.10 mL B.90 mL C.100 mL D.450 mL
练习册系列答案
相关题目
17.如图是CO2电催化还原为CH4的工作原理示意图.下列说法不正确的是( )
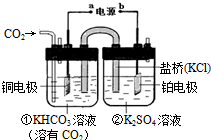

| A. | 该过程是电能转化为化学能的过程 | |
| B. | 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O | |
| C. | 一段时间后,②池中溶液的pH一定增大 | |
| D. | 盐桥中K+移向铜电极 |


 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H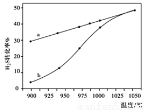
 应制取H2,反应方程式如下:
应制取H2,反应方程式如下: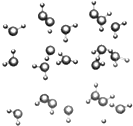 信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如图):
信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如图):