题目内容
在室温下,向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生CuI沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色.
(1)该反应中氧化剂是
(2)该反应的还原产物是
(3)1mol氧化剂在反应中得到电子的物质的量为
(4)某反应体系中有物质:Bi2(SO4)3、NaMnO4、H2O、MnSO4、NaBiO3、Na2SO4、H2SO4.请将NaBiO3之外的反应物与生成物分别填入以下空格内,配平化学计量数,并在氧化剂与还原剂之间标出电子转移的方向和数目.

(1)该反应中氧化剂是
Cu(IO3)2
Cu(IO3)2
;(2)该反应的还原产物是
CuII2
CuII2
;(3)1mol氧化剂在反应中得到电子的物质的量为
11mol
11mol
;(4)某反应体系中有物质:Bi2(SO4)3、NaMnO4、H2O、MnSO4、NaBiO3、Na2SO4、H2SO4.请将NaBiO3之外的反应物与生成物分别填入以下空格内,配平化学计量数,并在氧化剂与还原剂之间标出电子转移的方向和数目.

分析:(1)得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
(2)氧化剂对应的产物是还原产物;
(3)根据氧化剂和转移电子之间的关系式计算;
(4)根据化合价的升降判断参加氧化还原反应的反应物和生成物,然后根据元素守恒判断未参加氧化还原反应的反应物和生成物;
根据化合价 的升降判断电子的转移方向,根据得失电子的最小公倍数确定转移的电子数
(2)氧化剂对应的产物是还原产物;
(3)根据氧化剂和转移电子之间的关系式计算;
(4)根据化合价的升降判断参加氧化还原反应的反应物和生成物,然后根据元素守恒判断未参加氧化还原反应的反应物和生成物;
根据化合价 的升降判断电子的转移方向,根据得失电子的最小公倍数确定转移的电子数
解答:解:(1)向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生CuI沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色,则反应过程中有碘生成,同时说明铜离子、碘酸根离子得电子发生还原反应,则Cu(IO3)2作氧化剂,碘化钾中碘离子失电子作还原剂,
故答案为:Cu(IO3)2;
(2)该反应中Cu(IO3)2得电子生成CuI、I2,所以还原产物是CuI、I2,
故答案为:CuI、I2;
(3)根据氧化剂和转移电子之间的关系式得转移电子的物质的量=1mol×[(2-1)+(5-0)×2]=11mol,
故答案为:11mol;
(4)该反应中NaBiO3是反应物,根据Bi元素守恒,Bi2(SO4)3是生成物,Bi元素由反应物到生成物,化合价降低,所以NaBiO3是氧化剂;NaMnO4中锰元素的化合价是+7价,MnSO4中锰元素的化合价是+2价,要选取还原剂,只能是化合价由低变高,所以MnSO4作还原剂,NaMnO4是氧化产物;再根据元素守恒,反应物中还有硫酸,产物中还有Na2SO4和H2O;
该反应中,NaBiO3是氧化剂,MnSO4作还原剂;MnSO4→NaMnO4,锰元素由+2价→+7价,一个MnSO4失去5个电子;NaBiO3→Bi2(SO4)3,Bi元素由+5价→+3价,生成一个Bi2(SO4)3,需得4个电子,所以其得失电子的最小公倍数为20,则其化学反应方程式为10NaBiO3+4MnSO4+14H2SO4=5Bi2(SO4)3+4NaMnO4+3Na2SO4+14H2O
.
故答案为:10NaBiO3+4MnSO4+14H2SO4=5Bi2(SO4)3+4NaMnO4+3Na2SO4+14H2O;
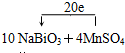 .
.
故答案为:Cu(IO3)2;
(2)该反应中Cu(IO3)2得电子生成CuI、I2,所以还原产物是CuI、I2,
故答案为:CuI、I2;
(3)根据氧化剂和转移电子之间的关系式得转移电子的物质的量=1mol×[(2-1)+(5-0)×2]=11mol,
故答案为:11mol;
(4)该反应中NaBiO3是反应物,根据Bi元素守恒,Bi2(SO4)3是生成物,Bi元素由反应物到生成物,化合价降低,所以NaBiO3是氧化剂;NaMnO4中锰元素的化合价是+7价,MnSO4中锰元素的化合价是+2价,要选取还原剂,只能是化合价由低变高,所以MnSO4作还原剂,NaMnO4是氧化产物;再根据元素守恒,反应物中还有硫酸,产物中还有Na2SO4和H2O;
该反应中,NaBiO3是氧化剂,MnSO4作还原剂;MnSO4→NaMnO4,锰元素由+2价→+7价,一个MnSO4失去5个电子;NaBiO3→Bi2(SO4)3,Bi元素由+5价→+3价,生成一个Bi2(SO4)3,需得4个电子,所以其得失电子的最小公倍数为20,则其化学反应方程式为10NaBiO3+4MnSO4+14H2SO4=5Bi2(SO4)3+4NaMnO4+3Na2SO4+14H2O
.
故答案为:10NaBiO3+4MnSO4+14H2SO4=5Bi2(SO4)3+4NaMnO4+3Na2SO4+14H2O;
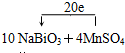 .
.点评:本题考查了氧化剂、氧化产物的判断、氧化还原反应方程式的配平,明确元素化合价是解本题关键,注意(1)题的氧化剂中有两种元素得电子,为易错点.

练习册系列答案
相关题目

 (2010?定海区模拟)I.(1)室温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
(2010?定海区模拟)I.(1)室温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是