题目内容
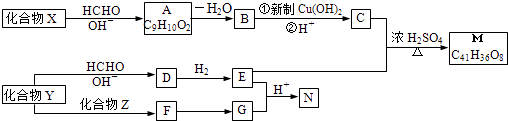
【题目】下表是元素周期表的一部分:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
针对表中的①~⑩号元素,用元素符号或化学式填空:
(1)在这些元素中,最易失电子的元素是____,非金属性最强的元素是____。
(2)化学性质最不活泼的元素是____,其原子结构示意图为__________。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式是______________________________。
(4)在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是___________________
(5)在③④⑥三种元素中,离子半径由大到小的顺序是___________________。
(6)元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是___________________。
(7)请设计实验证明⑦原子得电子能力比⑥原子强_____________________________。
【答案】 K F Ar 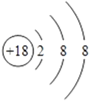 Al(OH)3+OH-=[Al(OH)4]- K>Si>Cl>F S>Mg>Al H2SO4 向Na2S溶液中滴加新制的氯水,若生成淡黄色沉淀,说明氯原子得电子能力比硫原子强。
Al(OH)3+OH-=[Al(OH)4]- K>Si>Cl>F S>Mg>Al H2SO4 向Na2S溶液中滴加新制的氯水,若生成淡黄色沉淀,说明氯原子得电子能力比硫原子强。
【解析】(1)在这些元素中,最易失电子的元素是金属性最强的K,非金属性最强的元素是F。(2)化学性质最不活泼的元素是稀有气体元素Ar,其原子结构示意图为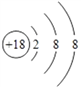 。(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物是氢氧化铝,与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=[Al(OH)4]-。(4)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是K>Si>Cl>F。(5)离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则在③④⑥三种元素中,离子半径由大到小的顺序是S>Mg>Al。(6)非金属性S>Se,则元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是H2SO4;(7)非金属性强的可以置换出弱的,则明⑦原子得电子能力比⑥原子强的实验可以是向Na2S溶液中滴加新制的氯水,若生成淡黄色沉淀,说明氯原子得电子能力比硫原子强。
。(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物是氢氧化铝,与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=[Al(OH)4]-。(4)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是K>Si>Cl>F。(5)离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则在③④⑥三种元素中,离子半径由大到小的顺序是S>Mg>Al。(6)非金属性S>Se,则元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是H2SO4;(7)非金属性强的可以置换出弱的,则明⑦原子得电子能力比⑥原子强的实验可以是向Na2S溶液中滴加新制的氯水,若生成淡黄色沉淀,说明氯原子得电子能力比硫原子强。

 黄冈创优卷系列答案
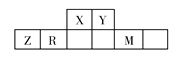
黄冈创优卷系列答案【题目】短周期元素X,Y,Z,W在元素周期表中相对位置如图所示其中Y所处的周期序数与族序数相等.按要求回答下列问题:
X | ||||
Y | Z | W |
(1)写出X的原子结构示意图 .
(2)列举一个事实说明X非金属性强于Z:(用化学方程式表示)
(3)含Y的氯化物呈酸性的原因是(用离子方程式表示)
【题目】下图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题:
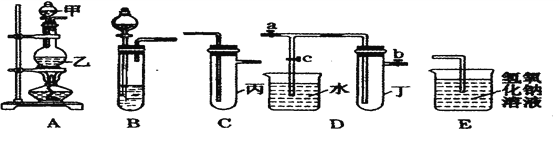
(1)将A、C、E相连后,以浓盐酸和_______(填写名称)为原料制取Cl2,仪器乙的名称是________。写出实验中制备氯气的离子方程式___________________。
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验实验操作、现象、结论如下:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将所得氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
Ⅱ | 向所得氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生一种酸性强于碳酸的物质 |
实验Ⅰ获得结论是否合理?_________(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):___________________________________________。
实验Ⅱ获得结论是否合理?_________(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):______________________________________________。
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱。则C中预期出现的现象是______________________________________________________________。
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2。一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先______________________________,再____________________________以使烧杯中的水进入试管丁,观察现象。