��Ŀ����
����Ŀ������ij��Ѫ����Ҫ�ɷ��������������壨FeSO47H2O����Ϊ�ⶨ�ò�Ѫ������Ԫ�صĺ�����ij��ѧ��ȤС�����������ʵ�鷽��������һ���ζ�����������KMnO4��Һ�ζ�������Ҫ�������£�
��ȡһ������Ѫ����Ʒ���ܽ��ȥ������������Ԫ�أ��������Ƴ�250mL������Һ��
����ȡ25.00mL������Һ����ƿ�У�
�����ữ��0.0100mol/LKMnO4��Һ�ζ����յ㣬��¼����KMnO4��Һ������ظ�һ������ʵ�飮
����֪��5Fe 2++MnO4��+8H+��5Fe 3++Mn2++4H2O����
��1��250mL������Һʱ��Ҫ�IJ����������ձ�����ͷ�ι��⣬���������������ƣ����ζ�ʱ�����ֿ��Ƶζ��ܵĻ���������ҡ����ƿ���۾�ע����ʱ����ζ��յ㣮
��2������ʵ���е�KMnO4��Һ��Ҫ�ữ�����ֱ�������������ữ���Բⶨ�����Ӱ���ǣ����� �� ���� �� ���� �� ���ƫ����ƫС������Ӱ�족��
��3��������������������FeSO4ת��ΪFe2O3 �� �ⶨ�������������������£�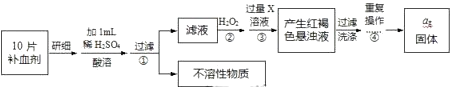
����ټ���1mlϡ�����Ŀ���� ��
��4��������Ƿ����ʡ�� �� ������ ��
��5����������ظ��������ȡ���ȴ��������ֱ��Ϊֹ��
��6������ʵ������Ԫ������ģ���ÿƬ��Ѫ������Ԫ�ص�����g���ú�a�Ĵ���ʽ��ʾ����
���𰸡�
��1��������250mL����ƿ����ƿ����Һ����ɫ�仯����Һ����dz�Ϻ�ɫ�ұ���30s����
��2��ƫС����Ӱ�죻ƫ��
��3����ֹ��������ˮ��
��4�����ܣ�Fe2+��Ӧ���ܱ�֤Fe2+ȫ��ת��ΪFe3+ �� ���Ȳ��ܵõ�������Fe2O3 �� ����ȷ����Fe�ĺ���
��5�����γ�����������С��0.1g
��6��0.07a
���������⣺��1����ȷ����250mL������Һ������ʱ��Ҫ�IJ��������в������ձ�����ͷ�ιܡ�250mL����ƿ���ݴ˵ζ��IJ���Ҫ���֪���ζ�ʱ�����ֿ��Ƶζ��ܵĻ���������ҡ����ƿ���۾�ע����ƿ����Һ����ɫ�仯����������Һ����dz�Ϻ�ɫ�ұ���30s����ʱ����ζ��յ㣻���Դ��ǣ�������250mL����ƿ����ƿ����Һ����ɫ�仯����Һ����dz�Ϻ�ɫ�ұ���30s���䣻��2��������ǿ�����ԣ����Լ�С������ص�������������л�ԭ�ԣ������˸�����ص������������ʵ��û��Ӱ�죬�����������ữ��ʹ�ⶨ���ƫС���������ữ��ʹ�ⶨ���ƫ���������ữ�Բⶨ�����Ӱ�죬���Դ��ǣ�ƫС����Ӱ�졢ƫ��3������������ˮ�⣬�ܽ�ʱҪ������ˮ�⣬���Լ���1mlϡ�����Ŀ���Ƿ�ֹ��������ˮ�⣬���Դ��ǣ���ֹ��������ˮ�⣻��4��Fe2+��Ӧ���ܱ�֤Fe2+ȫ��ת��ΪFe3+ �� ���Ȳ��ܵõ�������Fe2O3 �� ����ȷ����Fe�ĺ������ʲ���ڲ���ʡ�ԣ����Դ��ǣ����ܣ�Fe2+��Ӧ���ܱ�֤Fe2+ȫ��ת��ΪFe3+ �� ���Ȳ��ܵõ�������Fe2O3 �� ����ȷ����Fe�ĺ�������5���������һϵ�д�������������������Һ����ת��Ϊ����������Ҫ���ˡ�ϴ�ӵ�����������Ȼ��������������������ȴ�����������������Ϊ�˱�֤���ճ�֣�Ҫʹ���õ��Ĺ������Ϊֹ�������ظ��������ȡ���ȴ��������ֱ�����γ�����������С��0.1gΪֹ�����Դ��ǣ����γ�����������С��0.1g����6��ag����������Ԫ�ص�������Ϊ10Ƭ��Ѫ������������������ÿƬ��Ѫ������Ԫ�ص����� ![]() =0.07ag�����Դ��ǣ�0.07a��
=0.07ag�����Դ��ǣ�0.07a��

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�����Ŀ���±���Ԫ�����ڱ���һ���֣�
�� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | ||
4 | �� | �� |
��Ա��еĢ١����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��գ�
��1������ЩԪ���У�����ʧ���ӵ�Ԫ����____���ǽ�������ǿ��Ԫ����____��
��2����ѧ��������õ�Ԫ����____����ԭ�ӽṹʾ��ͼΪ__________��
��3��Ԫ�ص�����������Ӧ��ˮ�����г����Ե���������������������Һ��Ӧ�����ӷ���ʽ��______________________________��
��4���ڢڢݢߢ�����Ԫ���У�ԭ�Ӱ뾶�ɴ�С��˳����___________________
��5���ڢۢܢ�����Ԫ���У����Ӱ뾶�ɴ�С��˳����___________________��
��6��Ԫ�آޡ��������������Ӧ��ˮ�����У����Խ�ǿ����___________________��
��7�������ʵ��֤����ԭ�ӵõ��������Ȣ�ԭ��ǿ_____________________________��