题目内容
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化等再利用。请回答:
(1)已知:①.2Al2O3(s)=4Al(g)+3O2(g) △H1=+3351kJ/mol
②. 2C(s)+ O2(g)=2CO(g) △H2=-221kJ/mol
③. 2Al(g)+ N2(g)=2AlN(s) △H3=a kJ/mol
④. Al2O3(s)+ 3C(s)+ N2(g)=2AlN(s)+3CO(g) △H4=+1026kJ/mol
反应③的a=______,反应④自发进行的条件是______(填“高温”、“低温”或“任意温度”)
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量x mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应ⅠCO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H4
CH4(g)+2H2O(g)△H4
反应ⅡCO2(g)+H2(g)![]() CO(g)+H2O(g)△H5
CO(g)+H2O(g)△H5
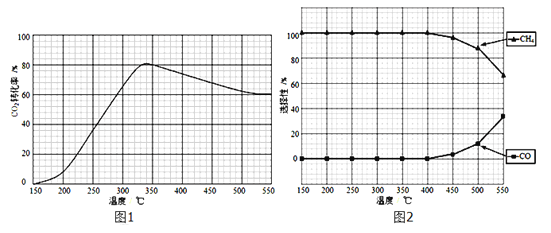
①下列说法正确的是___________。
A.△H5 小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应I在t1时刻达到平衡,平衡时容器体积为yL,该温度下反应I的平衡常数为____(用x、y 表示)。
(3)CO2溶于水形成H2CO3。已知常温下H2CO3 的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的电离平衡常数Kb=1.75×10-5。常温下,用氨水吸收CO2 可得到NH4HCO3 溶液,NH4HCO3 溶液显______(填“ 酸 性”、“ 中性” 或“ 碱性”);请计算反应NH4++HCO3-+ H2O![]() NH3·H2O+H2CO3 的平衡常数K=_____________。
NH3·H2O+H2CO3 的平衡常数K=_____________。
(4)据文献报道,二氧化碳可以在酸性水溶液中用情性电极电解得到乙烯,其原理如图所示。
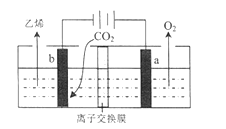
b电极上的电极反应式为____________________________,该装置中使用的是________(“ 阴”或“ 阳”) 离子交换膜。
【答案】 -318 高温 AB 625y2/x2 碱性 1.3×10-3 2CO2+12H++12e- ==== C2H4+4H2O 阳
【解析】(1). 已知①.2Al2O3(s)=4Al(g)+3O2(g) △H1=+3351kJ/mol,②. 2C(s)+ O2(g)=2CO(g) △H2=-221kJ/mol,③. 2Al(g)+ N2(g)=2AlN(s) △H3=a kJ/mol,④. Al2O3(s)+ 3C(s)+ N2(g)=2AlN(s)+3CO(g) △H4=+1026kJ/mol,根据盖斯定律,(①+②×3+③×2)÷2=④,解得△H3=-318 kJ/mol;若△G=△H-T△S<0,则反应能自发进行,反应④的△H>0,△S>0,因此该反应能自发进行的条件为高温,故答案为:-318;高温;
(2).①. A. 根据图1可知,CO2的转化率先增大是因为反应正向进行,到一定温度时达到平衡,升高温度CO2的转化率减小,说明正反应为放热反应,△H5小于零,故A正确;B. 由图2可知,随温度升高甲烷的选择性降低,CO的选择性增加,因此温度可影响产物的选择性,故B正确;C. CO2转化率先增大是因为反应正向进行未达到平衡状态,达到平衡状态后,随温度升高CO2的转化率减小,故C错误;D. CO2和H2混和气体(体积比1:4,总物质的量x mol)进行反应,其他条件不变,将CO2和H2的初始体积比改变为1:3,相当于减小氢气的量,CO2平衡转化率减小,故D错误;答案为:AB;
②. 350℃时,反应I在t1时刻达到平衡,平衡时容器体积为yL,二氧化碳的转化率为80%,根据三段式法有:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
起始量(mol) 0.2x 0.8x 0 0
转化量(mol) 0.16x 0.64x 0.16x 0.32x
平衡量(mol) 0.04x 0.16x 0.16x 0.32x
平衡常数K=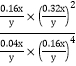 =625y2/x2,故答案为:625y2/x2;
=625y2/x2,故答案为:625y2/x2;
(3). 已知NH3·H2O的电离平衡常数Kb=1.75×105,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,Kb>K2,所以碳酸氢根离子的水解程度大于铵根离子的水解程度,NH4HCO3溶液显碱性;反应NH4++HCO3-+ H2O![]() NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=![]() =
= ![]() =1.3×10-3,故答案为:碱性;1.3×10-3;
=1.3×10-3,故答案为:碱性;1.3×10-3;
(4). 由图可知,电解时二氧化碳在b极上得电子发生还原反应生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,因离子交换膜只允许氢离子通过,所以是阳离子交换膜,故答案为:2CO2+12H++12e-=C2H4+4H2O;阳。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案