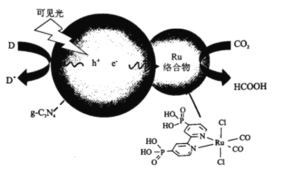
��Ŀ����
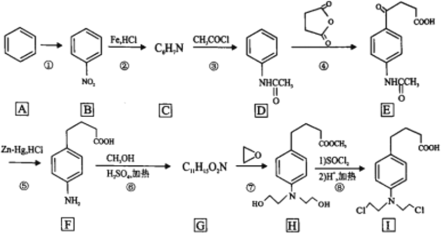
����Ŀ�������ᵪ���ǵ������ҩ�Ĵ������ϳ�·����ͼ��ʾ��
�ش��������⣺
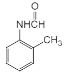
(1)��Ӧ��������Լ���������______________��B�еĹ�����������______________
(2)C�Ľṹ��ʽΪ______________��
(3)д�����б����ṹ�����ܷ���������Ӧ���ܷ���ˮ�ⷴӦ��D��ͬ���칹��Ľṹ��ʽ______________��(�����������칹��ֻ��д��3��)
(4)�ڵķ�Ӧ������______________��
(5)д��F��G�ķ�Ӧ����ʽ______________��
(6)����ɱ���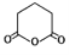 �Ʊ�
�Ʊ�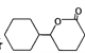 �ĺϳ�·��(���Լ���ѡ)��______________
�ĺϳ�·��(���Լ���ѡ)��______________
���𰸡�Ũ���ᣬŨ���ᣬ55��60��ˮԡ���� ���� ![]()
 ��
�� ��
�� ��
�� ��
��![]() �� ��ԭ��Ӧ
�� ��ԭ��Ӧ 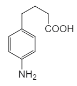 +CH3OH
+CH3OH![]()
 +H2O
+H2O 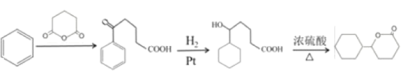
��������
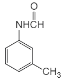
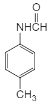
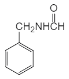
�������кϳ�·�ߣ�AΪ����������������Ӧ����BΪ������������������ԭ��CΪ![]() ��C����ȡ����Ӧ����D��D�����ӳɷ�Ӧ��E��E������ԭ��Ӧ��F��F��״�����������Ӧ����GΪ
��C����ȡ����Ӧ����D��D�����ӳɷ�Ӧ��E��E������ԭ��Ӧ��F��F��״�����������Ӧ����GΪ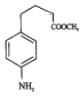 ��G�ͻ������鷢���ӳɷ�Ӧ��H��H������������ԭ�ӵ�ȡ��Ȼ���ٽ�����ˮ�ⷴӦ��I��
��G�ͻ������鷢���ӳɷ�Ӧ��H��H������������ԭ�ӵ�ȡ��Ȼ���ٽ�����ˮ�ⷴӦ��I��
(1)��Ӧ��Ϊ������������Ӧ����������������������Լ���������Ũ���ᡢŨ�����55��60��ˮԡ���ȣ�����B�Ľṹ��ʽ��֪��B�еĹ�����������������
(2)���ݿ�֪��CΪ![]() ��
��
(3)D��ͬ���칹����б����ṹ�����ܷ���������Ӧ���ܷ���ˮ�ⷴӦ����D��ֻ��1��Oԭ�ӣ��Һ�����������������ͬ���칹���о����м����γɵ������������Է����������� ��
�� ��
�� ��
�� ��
��![]() ��
��
(4)��Ӧ��Ϊ����ת��Ϊ�����ķ�Ӧ������ȥ��������Ϊ��ԭ��Ӧ��
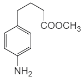
(5)F��״�����������Ӧ����G����Ӧ����Ϊ�� +CH3OH
+CH3OH![]()
 +H2O��
+H2O��
(6)����![]() �����������в���ܵķ�Ӧ��
�����������в���ܵķ�Ӧ�� ��
��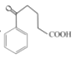 ������ԭ��Ӧ��
������ԭ��Ӧ��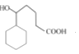 ��
�� ��Ũ����������·�����������ˮ�õ�
��Ũ����������·�����������ˮ�õ�![]() �����Ժϳ�·��Ϊ
�����Ժϳ�·��Ϊ 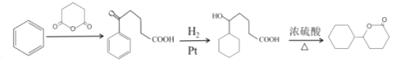 ��
��

����Ŀ�������ˮ��Һ�д��ڵ���ƽ�⡢ˮ��ƽ�⡢�ܽ�ƽ�⣬��ش��������⡣
��1����֪��������ĵ��볣�����±���
���� | CH3COOH | HCN | H2CO3 |
���볣��(25��) | Ka = 1.8��10��5 | Ka=4.3��l0��10 | Ka1=5.0��l0��7 Ka2=5.6��l0��11 |
�ٳ����£�pH��ͬ��������Һ��A��CH3COONa B��NaCN C��Na2CO3�������ʵ���Ũ���ɴ�С��˳����_______________(����)��
�ڽ�����CO2ͨ��NaCN��Һ����Ӧ�����ӷ���ʽ��____________________________��
�������£�����Ũ�ȵ�CH3COONa��ҺpH=9�������ӷ���ʽ��ʾ��Һ�ʼ��Ե�ԭ����__________________����Һ��c(CH3COO��)/c(CH3COOH) =___________
��2�������£���0.100 mol/L������Һ�ζ�20.00mL0.l00mol/L ��ij��ˮ��Һ���ζ�������ͼ��ʾ��������Ϊ������������

�� d����ʾ����Һ������Ũ���ɴ�С��˳������Ϊ__________________________________��
�� b����ʾ����Һ��c(NH3��H2O)��c(NH4+)=________(����Һ�е���������Ũ�ȱ�ʾ)��