题目内容
【题目】工业上用含有少量氧化铁杂质的废铜粉为原料,制取硫酸铜的主要过程如下图所示: 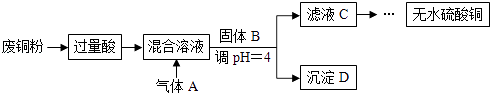
下列有关说法不正确的是( )
A.“过量酸”不适合用硝酸或浓硫酸,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3
B.通入的气体A可以是O2或Cl2
C.通入气体A之前的混合溶液中存在的阳离子是:Fe2+、Cu2+、H+
D.将从溶液中得到的硫酸铜晶体在空气中加热,可制得无水硫酸铜
【答案】B
【解析】解:因制备硫酸铜,废铜屑应加入稀硫酸中,稀硫酸、铜和氧化铁反应是氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成氯化亚铁和氯化铜;气体A应为空气,通入热的空气是为了氧化亚铁离子为三价铁离子,调整溶液PH除去铁离子,沉淀D为氢氧化铁,C为硫酸铜溶液,蒸发结晶可得到硫酸通过晶体,A.不适合用硝酸,易生成硝酸铜而引入新杂质,加入浓硫酸,发生氧化还原反应生成二氧化硫气体,污染环境,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3 , 目的是调整溶液pH除去铁离子,且不引入新杂质,故A正确;
B.不能通入氯气,否则生成氯化铜,引入新杂质,故B错误;
C.稀硫酸、铜和氧化铁反应是氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成氯化亚铁和氯化铜,反应的离子方程式为:Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+ , 反应离子方程式为:4Fe2++4H++O2═4Fe3++2H2O,混合溶液中存在的阳离子是:Fe2+、Cu2+、H+ , 故C正确;
D.硫酸铜晶体在空气中加热可失去结晶水,生成硫酸铜,故D正确.
故选B.
因制备硫酸铜,废铜屑应加入稀硫酸中,稀硫酸、铜和氧化铁反应是氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成氯化亚铁和氯化铜;气体A应为空气,通入热的空气是为了氧化亚铁离子为三价铁离子,调整溶液pH除去铁离子,沉淀D为氢氧化铁,C为硫酸铜溶液,蒸发结晶可得到硫酸通过晶体,以此解答该题.

 阅读快车系列答案
阅读快车系列答案【题目】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题.
元素 | 性质或结构信息 |
A | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |
B | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍 |
C | 单质是双原子分子,常温、常压下是淡黄绿色气体,原子的L层再增加一个电子即达到稳定结构 |
D | +2价阳离子的核外电子排布与氖原子相同 |
(1)上表中与A属于同一周期的元素是(写元素符号) , 画出D离子的结构示意图 .
(2)已知C的单质能与H2O发生置换反应生成O2 , 写出C单质与水反应的化学方程式
(3)对元素B的单质或化合物描述正确的是 . a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下氢气能与单质B反应
(4)A和D两元素活泼性较强的是(写元素名称) .

