��Ŀ����
����Ŀ����1��1.00L 1.00molL��1H2SO4��Һ��2.00L 1.00molL��1 NaOH��Һ��ȫ��Ӧ���ų�114.6kJ�������÷�Ӧ���к�����HΪ_____����ʾ���к��ȵ��Ȼ�ѧ����ʽΪ_____��
��2����25����101KPaʱ��1.00g C6H6��l��ȼ������CO2��g����H2O��l�����ų�41.8kJ��������C6H6��ȼ����Ϊ_____KJmol��1���÷�Ӧ���Ȼ�ѧ����ʽΪ_____��
��3��������AX3�͵���X2��һ�������·�Ӧ�����ɻ�����AX5���ش��������⣺
��֪AX3���۵�ͷе�ֱ�Ϊ��93.6����76����AX5���۵�Ϊ167��������ʱAX3������X2��Ӧ����1mol AX5���ų�����123.8kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ_____��
���𰸡� ��57.3kJmol��1 H2SO4��aq��+NaOH��aq��=Na2SO4��aq��+H2O��l����H=��57.3kJmol��1 3260.4 C6H6��l��+![]() O2��g��=6CO2��g��+3H2O��l����H=��3260.4kJmol��1 AX3��l��+X2��g��=AX5��s����H=��123.8kJmol��1
O2��g��=6CO2��g��+3H2O��l����H=��3260.4kJmol��1 AX3��l��+X2��g��=AX5��s����H=��123.8kJmol��1
����������1���к��ȣ�����к�����1molҺ̬H2O�ų���������1.00L 1.00molL��1H2SO4��Һ��2.00L 1.00molL��1 NaOH��Һ��ȫ��Ӧ������2molH2O���ų�114.6kJ��������ô����1molH2O�ų�����Ϊ57.3kJ�����Ը÷�Ӧ���к�����H=��57.3 kJmol��1����ʾ���к��ȵ��Ȼ�ѧ����ʽΪH2SO4��aq��+NaOH��aq��=Na2SO4��aq��+H2O��l����H=��57.3 kJmol��1��
�ʴ�Ϊ����57.3 kJmol��1��H2SO4��aq��+NaOH��aq��=Na2SO4��aq��+H2O��l�� ��H=��57.3 kJmol��1��
��2��ȼ������1mol������ȼ�������ȶ�������ų���������1.00g C6H6��l��ȼ������CO2��g����H2O��l�����ų�41.8kJ��������1molC6H6��l��Ϊ78g������1molC6H6��l��ȼ������CO2��g����H2O��l��������Ϊ41.8kJ��78=3260.4kJ����÷�Ӧ���Ȼ�ѧ����ʽΪC6H6��l��+![]() O2��g��=6CO2��g��+3H2O��l����H=��3 260.4 kJmol��1��
O2��g��=6CO2��g��+3H2O��l����H=��3 260.4 kJmol��1��
�ʴ�Ϊ��3260.4��C6H6��l��+![]() O2��g��=6CO2��g��+3H2O��l����H=��3 260.4 kJmol��1��
O2��g��=6CO2��g��+3H2O��l����H=��3 260.4 kJmol��1��
��3������ʱ��AX3ΪҺ̬��AX5Ϊ��̬������1mol AX5���ų�����123.8kJ���÷�Ӧ���Ȼ�ѧ����Ϊ��AX3��l��+X2��g��=AX5��s����H=��123.8kJmol��1��
�ʴ�Ϊ��AX3��l��+X2��g��=AX5��s����H=��123.8kJmol��1��

����Ŀ��ij�о���ѧϰС��Ϊ��̽������ĵ������������������ʵ��:
��1��ȡ����������250 mL 0.4 mol��L��1�Ĵ�����Һ����0.4 mol��L��1�Ĵ�����Һϡ�ͳ�����Ũ�ȵ���Һ������NaOH����Һ�����������Һ��Ũ�Ƚ��б궨���ش��������⣺
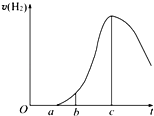
�ٽ�һ�������ı������ˮϡ�����У���Һ�ĵ��������仯����ͼ��ʾ����ϡ��������Һ��pH�ɴ�С��˳��______������ĸ����

������250 mL 0.4 mol��L��1 ������Һʱ��Ҫ�õ��IJ�����������Ͳ���ձ�������������ͷ�ιܺ�____________��
��Ϊ�궨�ô�����Һ��ȷŨ�ȣ���0.2000 mol��L��1��NaOH��Һ��20.00 mL������Һ���еζ������εζ�����NaOH��Һ��������£�
ʵ����� | 1 | 2 | 3 | 4 |
����NaOH��Һ�����(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
�ô�����Һ��ȷŨ��Ϊ_____________������С�������λ���������궨�����У���ɲⶨ���ƫ�ߵ�ԭ�������_______________����ѡ����ѡ���÷֣���
a��δ�ñ�Һ��ϴ��ʽ�ζ���
b���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ
c��ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
d���ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ
��2����С��ͬѧ̽��Ũ�ȶԴ������̶ȵ�Ӱ��ʱ����pH�Ʋⶨ25��ʱ��ͬŨ�ȵĴ����pH���������£�
����Ũ��( mol��L��1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
�ٸ��ݱ������ݣ����Եó�������������ʵĽ��ۣ�����Ϊ�ó��˽��۵�������______________________________________________________________��
�ڼ�����pH��ֽ�� 0.1mol��L��1 ������ҺpH�ķ���___________��
������ˮ���������ʵ��֤����������Ա�̼���ǿ��______________________��
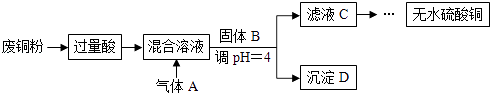
����Ŀ���뵼�������г���Ҫ���Ʋ��ӣ��Ա�֤���Ƶ����ʣ����Ȼ��ף�PCl3����һ����Ҫ�IJ��Ӽ���ʵ����Ҫ�û��ף����ף�������Cl2ģ�ҵ������ȡPCl3 �� װ������ͼ��ʾ�������ּг�װ����ȥ��
��֪����������Cl2��Ӧ����PCl3 �� �����Cl2��Ӧ����PCl5��HCl����O2������POCl3 �� POCl3����PCl3 �� PCl3��POCl3���۷е���±���
���� | �۵�/�� | �е�/�� |
PCl3 | ��112 | 75.5 |
PCl5 | 2 | 105.3 |
��ش���������
��1��װ���������������ӷ���ʽΪ
��2��B�е��Լ��� �� E�д���ˮ�������� �� F�м�ʯ�ҵ�������
��3��ʵ��ʱ�����װ�������Ժ��ȴ�K3ͨ������CO2 �� ��Ѹ�ټ�����ף�ͨ����CO2��������ͨ������K1��K2�ܳ�ȥA��Bװ���еĿ���������ķ�����
��4���ֲ�Ʒ����POCl3��PCl3�ȣ���������ȳ�ȥPCl5 �� ͨ������ʵ����������ƣ������ɵõ�������PCl3
��5��ͨ�����淽���ɲⶨ��Ʒ��PCl3��������������Ѹ�ٳ�ȡ100g��Ʒ����ˮ��Ӧ�����250mL��Һ��
��ȡ������Һ25.0mL�������м���0.1mol 10mL��ˮ����ַ�Ӧ�������������Һ�м��뼸�ε�����Һ����0.1mol/L��Na2S2O3��Һ�ζ����ζ��յ�������
���ظ��ڡ��۲�����ƽ������Na2S2O3��Һ8.40mL����֪H3PO3+H2O+I2=H3PO4+2HI��I2+2Na2S2O3=2NaI+Na2SO4�����������ݣ��ò�Ʒ��PC3������������ ��