题目内容
【题目】研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
①一定条件下,将体积比为1:2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C. N2和CO2的体积比保持不变 D. v正(CO)=2v逆(N2)
②20min时,若改变反应条件,导致N2浓度发生如下图1所示的变化,则改变的条件可能是_____(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2量 D.缩小容器体积
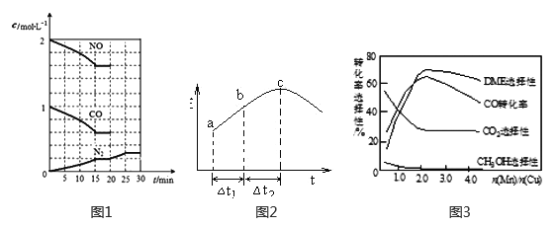
(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) ![]() SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2 时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图3回答问题。催化剂中n(Mn)/n(Cu)约为__________时最有利于二甲醚的合成。
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | lmolCH3OH | 2molCH3OH | |
平衡 时的 数据 | CH3OH/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ | |
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法中正确的是______
A.2c1>c3 B. a+b=92.9 C.2p23 D.a1+a3<1
【答案】 AD B D 2.0 BD
【解析】试题分析:本题考查化学平衡的标志,外界条件对化学反应速率和化学平衡的影响,图像的分析和等效平衡规律的应用。
(1)①A项,正反应为气体分子数减小的反应,从正反应开始建立平衡,建立平衡的过程中气体总物质的量减小,在恒容容器中,体系压强减小,压强不变说明达到平衡状态,正确;B项,该反应中气体都呈无色,混合气体的颜色始终保持无色,颜色不变不能作为平衡的标志,错误;C项,N2和CO2起始都为0,转化生成N2和CO2的体积比始终保持1:2,N2和CO2的体积比保持不变不能作为平衡的标志,错误;D项,用CO表示的正反应速率与用N2表示的逆反应速率之比等于2:1,等于化学计量数之比说明反应达到了平衡状态,正确;答案选AD。
②由图1可见,改变条件的瞬间N2浓度没有变化,后来N2的浓度逐渐增大达到新平衡。A项,加入催化剂对平衡无影响,N2浓度不变,错误;B项,降低温度平衡正向移动,N2浓度增大,正确;C项,增加CO2的量,平衡逆向移动,N2浓度减小,错误;D项,缩小容器体积的瞬间N2浓度骤然增大,错误;答案选B。
(2)A项,c点正反应速率达最大,后正反应速率逐渐减小,c点没有达到平衡状态,错误;B项,从正反应开始建立平衡,随着时间的推移在达到平衡前,反应物浓度逐渐减小,b点反应物浓度大于c点,错误;C项,该容器为绝热容器,则影响化学反应速率的因素有两个:浓度和温度,从浓度的角度看随着时间的推移反应物浓度减小,反应速率减慢,但c点前正反应速率逐渐加快说明温度的影响为主且是升高温度,由此可见该反应是放热反应,反应物的总能量高于生成物的总能量,错误;D项,c点前随着时间的推移,正反应速率加快,相同时间内,正反应速率越快,SO2的转化率越大,Δt1=Δt2时,a~b段SO2的转化率小于b~c段,正确;答案选D。
(3)由图3分析,催化剂中n(Mn)/n(Cu)约为2.0时,CO的转化率最大,DME选择性最大,CH3OH选择性接近于0,说明催化剂中n(Mn)/n(Cu)约为2.0时最有利于二甲醚的合成。
(4)容器的特点为恒温恒容,反应的特点为正反应是气体分子数减小的反应。甲从正反应开始建立平衡,乙从逆反应开始建立平衡,用一边倒换算之后乙的起始各物质物质的量与甲对应相等,所以甲、乙为恒温恒容下完全全等的等效平衡,则c2=c1,a+b=92.9,p1=p2,a1+a2=1;丙中起始投入的CH3OH物质的量为乙中两倍,可设计一个两倍体积的容器称为丁,起始丁容器中加入2molCH3OH,在相同条件下达到平衡时,丁相当于两个乙,则丁中平衡时的数据:CH3OH浓度与乙中相等为c2mol/L、反应吸收的能量为2bkJ、体系压强与乙中相等为p2、反应物的转化率与乙中相等为a2;丙相当于在丁达到平衡后将体积压缩为一半,增大压强,平衡正向移动,CH3OH物质的量增大,则c3![]() 2c2、反应吸收的能量小于2bkJ、体系压强p2
2c2、反应吸收的能量小于2bkJ、体系压强p2![]() p3
p3![]() 2p2、反应物转化率a3
2p2、反应物转化率a3![]() a2;综上分析,A项,c3
a2;综上分析,A项,c3![]() 2c1,错误;B项,a+b=92.9,正确;C项,p3
2c1,错误;B项,a+b=92.9,正确;C项,p3![]() 2p2,错误;D项,a1+a3
2p2,错误;D项,a1+a3![]() 1,正确;答案选BD。
1,正确;答案选BD。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】恒温恒容下,向2L密闭容器中加入MgSO4和CO(g),发生反应:
MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
0 | 2.00 | 2.00 | 0 |
2 | 0.80 | ||
4 | 1.20 |
下列说法正确的是
A. 反应在0~2min内的平均速率为v(SO2)=0.6mol·L-1·min-1
B. 反应在2~4min内容器内气体的密度没有变化
C. 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D. 保持其他条件不变,起始时向容器中充入1.00molMgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol