题目内容
【题目】某化学兴趣小组进行Fe2+与Fe3+转化实验:向FeCl2溶液中加入少量KSCN溶液,溶液无明显变化,再加入少量双氧水,溶液变红,继续滴加至过量,发现溶液红色褪去,同时有气泡生成.他们针对此异常现象展开探究,请回答有关问题:
(1)该小组对于产生气体的原因有两种猜测:
猜测一:__________________________________________。
猜测二:红色褪去可能是SCN-被H2O2氧化,同时产生的气体中可能含有氮气、二氧化碳、二氧化硫。
(2)化学小组针对猜测二设计下面的实验来验证气体成分:
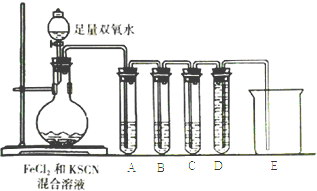
①试管A中盛放品红溶液,若实验中品红溶液褪色,证明气体中含有____________;
②试管B中的溶液是酸性高锰酸钾溶液,其目的是________________,预期试管B中的现象是________________________________。
③试管C中盛有澄清石灰水,目的是___________________;试管D和烧杯的作用是______________。④以上实验证明SCN-能被H2O2氧化.请写出该反应的离子方程式:___________________________________。
(3)根据题目信息及以上实验推断,Fe2+和SCN-中还原性较强的是_______,理由是_________。
(4)有人认为SCN-的氧化产物可能还有硫酸根离子,请设计一个简单实验证明该假设是否正确_____________________________。
【答案】 氯化亚铁被过氧化氢氧化为氯化铁,在氯化铁的催化作用下过氧化氢分解,放出了氧气 SO2 除尽气体中的SO2 溶液颜色变浅但未褪色 证明气体中还含有CO2 收集生成的N2 9H2O2+2SCN-+2H+=2SO2↑+2CO2↑+N2↑+10H2O Fe2+ 向FeCl2和 KSCN溶液中加入少量双氧水,溶液变红,说明双氧水优先和Fe2+反应 取烧瓶中褪色后的溶液少许,加盐酸酸化后再滴入几滴BaCl2溶液,溶液变浑浊,证明该反应生成了硫酸根离子
【解析】试题分析:(1)亚铁离子可以被过氧化氢氧化为铁离子,过氧化氢在铁离子的催化作用下发生了分解反应生成了氧气和水;
(2)二氧化硫具有漂白性,可以使品红溶液褪色,酸性高锰酸钾溶液吸收二氧化硫气体,二氧化硫吸收干净后,能使澄清石灰水变浑浊的气体就是二氧化碳,试管D和烧杯的作用是收集氮气,依据题干所给反应物和产物书写离子方程式.
(3)氧化剂优先氧化还原性强的还原剂,向FeCl2和 KSCN溶液中加入少量双氧水,溶液变红,说明双氧水优先和Fe2+反应;
(4)硫酸根离子的检验试剂是:先稀盐酸后氯化钡溶液。
解析:(1)亚铁离子可以被过氧化氢氧化为铁离子,过氧化氢在铁离子的催化作用下发生了分解反应生成了氧气和水;
(2)二氧化硫具有漂白性,可以使品红溶液褪色,①试管A中盛放品红溶液,若实验中品红溶液褪色,证明气体中含有SO2;②酸性高锰酸钾溶液除尽二氧化硫气体,因为高锰酸钾溶液过量,所以高锰酸钾溶液颜色变浅;③二氧化硫吸收干净后,能使澄清石灰水变浑浊的气体就是二氧化碳,试管C中盛有澄清石灰水,目的是检验CO2;试管D和烧杯的作用是收集氮气;以上实验证明SCN-能被H2O2氧化的离子方程式为:9H2O2+2SCN-+2H+=2SO2↑+2CO2↑+N2↑+10 H2O;
(3)向FeCl2和 KSCN溶液中加入少量双氧水,溶液变红,说明双氧水优先和Fe2+反应,因此还原性较强的是Fe2+;
(4)硫酸根离子的检验方法为:取烧瓶中褪色后的溶液少许,加盐酸酸化后再滴入几滴BaCl2溶液,溶液变浑浊,证明该反应生成了硫酸根离子。

【题目】研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
①一定条件下,将体积比为1:2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C. N2和CO2的体积比保持不变 D. v正(CO)=2v逆(N2)
②20min时,若改变反应条件,导致N2浓度发生如下图1所示的变化,则改变的条件可能是_____(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2量 D.缩小容器体积
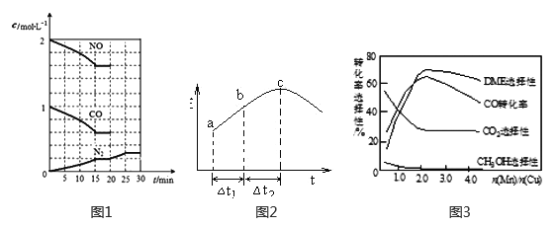
(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) ![]() SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2 时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图3回答问题。催化剂中n(Mn)/n(Cu)约为__________时最有利于二甲醚的合成。
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | lmolCH3OH | 2molCH3OH | |
平衡 时的 数据 | CH3OH/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ | |
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法中正确的是______
A.2c1>c3 B. a+b=92.9 C.2p23 D.a1+a3<1
【题目】下列反应中,相关示意图错误的是
A | B | C | D |
将二氧化硫通入到一定量饱和氯水中 | 将盐酸滴入到NaHCO3和Na2CO3混合溶液中 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. A B. B C. C D. D
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g);
2SO3(g); ![]() 。实验测得起始、平衡时的有关数据如下表:下列叙述正确的是 ( )
。实验测得起始、平衡时的有关数据如下表:下列叙述正确的是 ( )
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
A. 若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
B. Q1=Q2=Q3=197 kJ
C. 甲、乙、丙3个容器中反应的平衡常数不相等
D. 达到平衡时,丙容器中SO2的体积分数最大







