题目内容
17.已知2SO2(g)+O2(g)?2SO3(g);△H=-196.64kJ•mol-1,下列说法正确的是( )| A. | 该反应是吸热反应 | |
| B. | SO2燃烧热为196.64kJ•mol-1 | |
| C. | 在容器中充入1mol SO2和0.5mol O2充分反应,热变化为98.32kJ | |
| D. | 当有NA个电子发生转移时,热变化为49.16kJ |
分析 A、2SO2(g)+O2(g)?2SO3(g);△H=-196.64kJ•mol-1,△H<0,为放热反应;
B、依据燃烧热的定义判断,燃烧热:1mol纯物质完全燃烧生成稳定的氧化物所放出的热量;
C、此反应为可逆反应,据此判断;
D、有NA个电子发生转移时,有0.5molSO2完全反应,据此判断.
解答 解:A、由热化学反应方程式得出此反应的热效应小于0,即为放热反应,故A错误;
B、反应中可燃物的物质的量为2mol,不符合燃烧热的定义,故B错误;
C、此反应为可逆反应,热效应的含义是完全反应放出的热量,故在容器中充入1mol SO2和0.5mol O2充分反应,热变化小于98.32kJ,故C错误;
D、反应2SO2(g)+O2(g)?2SO3(g);△H=-196.64kJ•mol-1,转移电子数为4mol,当有NA个电子发生转移时,即有0.5mol二氧化硫反应,热变化为$\frac{196.64}{4}$=49.16kJ,故D正确,故选D.
点评 本题主要考查的是放热反应与吸热反应,难度不大,掌握可逆反应的特点以及燃烧热的定义是解决本题的关键.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
8.下列说法中,不正确的是( )
| A. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H互为同位素 | B. | 淀粉和纤维素互为同分异构体 | ||
| C. |  和 和 属于同一种物质 属于同一种物质 | D. | CH4和C2H6互为同系物 |
5.下列除杂方法中正确的一组是( )
| A. | 溴苯中混有溴,加入氢氧化钠溶液,振荡、静置、分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液,振荡、静置、分液 |
2.某有机物A用质谱仪测定如图①,核磁共振氢谱示意图如图①,核磁共振氢谱示意图如图②,则A的结构简式可能为( )
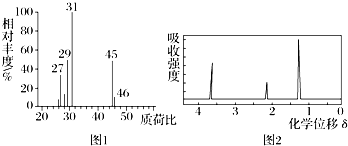

| A. | CH3CH2OH | B. | CH3CHO | C. | HCOOH | D. | CH3CH2CH2COOH |
9.化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A. | 高纯度的硅单质用于制作光导纤维 | |
| B. | 合金相对于金属单质,其硬度更大、熔沸点更高 | |
| C. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| D. | 过氧化钠可以用在潜艇和呼吸面罩中作供氧剂 |
6.洗涤下列试管使用的试剂,不正确的是( )
| A. | 沾有苯酚的试管,用碳酸钠溶液洗涤 | |
| B. | 做过银镜反应的试管,用稀氨水洗涤 | |
| C. | 沾有油脂的试管,用氢氧化钠溶液洗涤 | |
| D. | 做过制取酚醛树脂实验的试管,用酒精浸泡后再清洗 |
7.设NA阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4L苯含有的分子数为NA | |
| B. | 标准状况下,11.2L乙烷中含有共价键的数目为3NA | |
| C. | 常温下,1mol的羟基中含有的电子数为9NA | |
| D. | 1mol冰醋酸和1mol乙醇在浓硫酸加热下充分反应生成水的个数为NA |
 .
. .
.