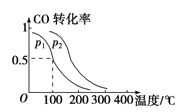
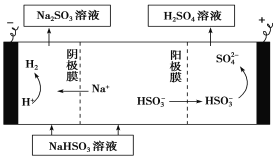
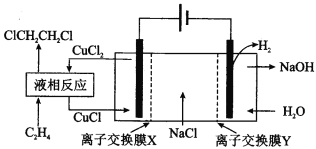
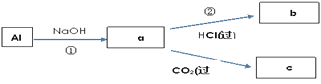
题目内容
【题目】以石油化工产品为原料合成聚酯类功能高分子材料R及某药物合成原料E的一种合成路线如下(部分反应条件和产物略去):
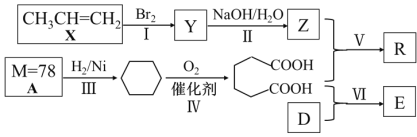
已知D与乙醇属于同系物,E在核磁共振氢谱上有3组峰且峰面积比为2∶2∶3。请回答下列问题:
(1)Y的名称是____;Z的官能团名称是____;A的分子式是__________ ;
(2)反应Ⅳ的反应类型是_____;
(3)写出X发生加聚反应的化学方程式________;
(4)写出II反应的化学方程式_____________;
(5)写出Ⅵ反应的化学方程式___________;
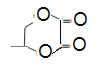
(6)写出由Z和乙二酸在浓硫酸的作用下反应生成的一种六元环状化合物的键线式____。
【答案】1,2-二溴丙烷 羟基 C6H6 氧化反应 n CH2=CHCH3![]()
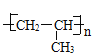 CH3CHBrCH2Br+2NaOH
CH3CHBrCH2Br+2NaOH![]()
![]() +2NaBr
+2NaBr 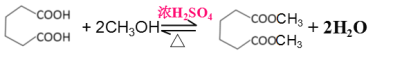
【解析】
丙烯与溴发生加成反应生成Y,则Y为CH3CHBrCH2Br;在碱性溶液中Y水解生成Z,则Y为CH3CHOHCH2OH;A的摩尔质量为78g/mol,其与氢气加成生成环己烷,则A为苯;Z与![]() 发生缩聚反应生成R和水;已知D与乙醇属于同系物,则含有1个羟基,与
发生缩聚反应生成R和水;已知D与乙醇属于同系物,则含有1个羟基,与![]() 发生酯化反应后生成的E在核磁共振氢谱上有3组峰且峰面积比为2∶2∶3,则E的结构为对称结构,D只能提供1中氢原子,则D为甲醇,E为
发生酯化反应后生成的E在核磁共振氢谱上有3组峰且峰面积比为2∶2∶3,则E的结构为对称结构,D只能提供1中氢原子,则D为甲醇,E为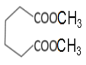 。
。
(1)Y为CH3CHBrCH2Br,名称为1,2-二溴丙烷;Z为CH3CHOHCH2OH,含有的官能团的名称为羟基;A为苯,分子式为C6H6;
(2)反应Ⅳ为环己烷与氧气反应,发生氧化反应;
(3)X为丙烯,发生加聚反应生成聚丙烯,方程式为CH2=CHCH3![]()
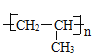 ;
;
(4)反应II为CH3CHBrCH2Br在碱性条件下水解生成醇和溴盐,方程式为CH3CHBrCH2Br+2NaOH![]()
![]() +2NaBr;
+2NaBr;
(5)反应Ⅵ为![]() 与2倍的甲醇发生酯化反应生成
与2倍的甲醇发生酯化反应生成 和水,方程式为
和水,方程式为![]() +2CH3OH
+2CH3OH
 +2H2O;
+2H2O;
(6)CH3CHOHCH2OH与HOOC-COOH在浓硫酸的作用下发生酯化反应生成六元环为 。
。

【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):
属于电解质的是_______________ ,属于非电解质的是____________________ 。
(2)过量②的水溶液与⑦反应的离子方程式 ________________________________。
(3)已知用金属钠制取氧化钠,可有多种方法:
①4Na + O2=2Na2O; ②4Na + CO2 =2Na2O + C;③2NaNO2 + 6Na =4Na2O + N2↑
在上述三种方法中,最好的是_________ ,原因是___________。
(4)某实验小组通过下列实验探究过氧化钠与水的反应:

①用化学方程式解释使酚酞变红的原因 _______________________________;依据实验现象推测红色褪去的原因是___________________________________。
②加入MnO2反应的化学方程式为 ___________________________________ 。
(5)在实验室模拟侯氏制碱法制备碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。该过程的化学方程式为:____________
(6)在化学课上老师向NaOH溶液通入CO2后无明显现象,那我们如何通过实验证明CO2与NaOH发生了反应?某化学小组同学将过量的干冰放入氢氧化钠溶液中,利用数字化传感器测定溶液pH的变化,如图所示,请用化学方程式回答下列问题:
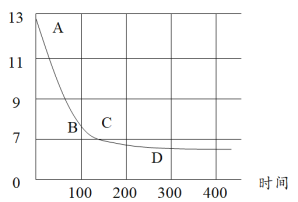
①BC段变化原因可能是 ___________________________________________________________ ;
②CD段变化原因可能是 ___________________________________________________________ 。