题目内容
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)三种金属与同浓度盐酸反应,反应最慢的是___(填选项)。
a.钠 b.铝 c.铁
(2)金属钠与水发生反应的离子方程式为___;(填选项)
a.2Na +2H2O=2NaOH+H2↑
b.2Na+2H2O=2Na++2OH-+H2↑
c.2Na +2H2O=2Na++2OH-+O2↑
(3)可观察到的实验现象正确的是__(填选项)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(4)填写a、b、c化学式并书写①的化学方程式(a、b、c均为含Al化合物);
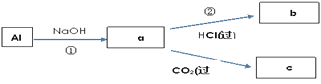
a:___,b:___,c:___;
①____________;
(5)Fe跟Cl2在一定条件下反应,所得产物为___。
(6)将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成__色。
b.向另一支试管中滴加NaOH溶液,产生__色沉淀。
【答案】c b bc NaAlO2 AlCl3 Al(OH)3 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ FeCl3 红 红褐
【解析】
(1)金属越活泼,与盐酸反应与剧烈,根据钠、铝、铁的活泼性分析判断;
(2)钠与水反应生成NaOH和氢气,且钠的密度比水的密度小,据此分析解答(2)和(3);
(4)由转化可知,①中Al与NaOH反应生成NaAlO2,②中NaAlO2与过量盐酸反应生成AlCl3,NaAlO2与过量二氧化碳反应生成Al(OH)3沉淀,据此分析解答;
(5)Fe跟Cl2反应生成氯化铁,溶液含铁离子,遇KSCN变为血红色,加NaOH生成红褐色沉淀,据此分析解答(5)和(6)。
(1)金属越活泼,与盐酸反应与剧烈,钠、铝、铁中钠最活泼,铁活泼性最差,与同浓度盐酸反应,反应最慢的是铁,故答案为:c;
(2)钠与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故答案为:b;
(3)钠与水反应生成氢氧化钠和氢气,可观察到钠浮在水面上,熔成小球、小球四处游动,故答案为:bc;
(4)由上述分析可知,a、b、c分别为NaAlO2、AlCl3、Al(OH)3,反应①的离子方程式分别为2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:NaAlO2;AlCl3;Al(OH)3;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(5)Fe跟Cl2在一定条件下反应生成氯化铁,化学式为FeCl3,故答案为:FeCl3;
(6)将FeCl3溶于水配成溶液,分装在两支试管中。a.若向其中一支试管中滴加KSCN溶液,溶液变成红色;b.向另一支试管中滴加NaOH溶液,反应生成红褐色的氢氧化铁沉淀,反应的离子方程式是Fe3++3OH-═Fe(OH)3↓,故答案为:红;红褐。