题目内容
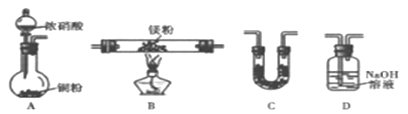
【题目】化学与生产、生活密切相关。下列物质用途不正确的是
A. Na2O2 是强氧化剂,有漂白性,可用作食品的漂白剂
B. Al2O3熔点很高,可用作耐火材料,制作耐火管和耐火坩埚
C. NaHCO3能与酸反应,可制成胃药治疗胃酸过多
D. Fe2O3是红棕色固体,可用作红色油漆和涂料
【答案】A
【解析】A.Na2O2 是强氧化剂,有漂白性,但不能用作食品的漂白剂,A错误;B.Al2O3熔点很高,可用作耐火材料,制作耐火管和耐火坩埚,B正确;C.NaHCO3能与酸反应,可制成胃药治疗胃酸过多,C正确;D.Fe2O3是红棕色固体,可用作红色油漆和涂料,D正确,答案选A。

【题目】工业燃烧煤、;石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对 废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ脱硝:
己知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+l33kJ·mol-1
H2O(g)=H2O(l) △H=-44kJ·mol-1
在催化剂存在下,H2还原NO2可生成水蒸气和其它无毒物质的热化学方程式为:____________。
Ⅱ.脱碳:在2L的密闭容器中充入2mo1 CO2和6mol H2,在适当的催化剂作用下发生反应:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H<0
CH3OH(l)+H2O(l) △H<0
①该反应自发进行的条件是___________(填“”低温或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是________(填字母)
a.混合气体的平均摩尔质量保持不变
b. CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d. 混合气体的密度保持不变
e. 1mol CO2生成的同时有3 mul H―H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,请画出t2~t4CO2浓度随时间的变化。______

(2)改变温度,使反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
l0min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
① 达到平衡时,反应I、Ⅱ对比:平衡常数K(I)_____K(Ⅱ)(填“>”“<”或“=”下同);平衡时CH3OH的浓度 c(I)______c(Ⅱ)。
②对反应I,前10min内的平均反应速率v(CH3OH)=_________。在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1________T2(填“>”“<”或“=”)。
【题目】下图是元素周期表的一部分,表中列出了①⑨种元素的位置,请根据要求回答问题。
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VIA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为________________。
(2)②与④形成的化合物的电子式可表示为 _________________________________________。
(3)这些元素的最髙价氧化物对应的水化物中,酸性最强的是____________________(填化学式)。
(4)写出⑤与氢氧化钠溶液反应的化学方程式:_____________________________________。