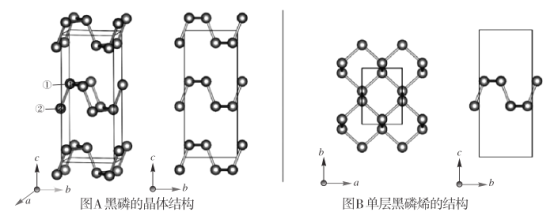
题目内容
【题目】I.字母A~K代表常见物质,在一定条件下能发生如图所示变化。
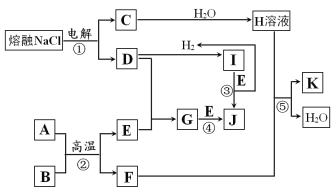
已知:反应②中A为黑色粉末,B为金属单质,且n(A):n(B)=3:2。反应③和④均在水溶液中进行。
(1)写出J的名称:___。
(2)写出反应②的化学方程式:___。
(3)写出反应⑤的离子方程式:___。
II.某研究性学习小组的同学以Fe(NO3)3溶液来探究Fe3+能否氧化Ag为题。他们选用少量的Fe(NO3)3溶液与做过银镜反应的试管进行实验。现象:银镜部分溶解,试管上方出现少量淡淡的红棕色气体。
请你判断:以上实验能否得到相关结论。
若你认为能得出结论,请简述理由:___。
若你认为不能得出结论,请在此实验基础上,再继续实验(试剂任选),直至得出相关结论。请设计实验(写出实验操作、现象和结论):___。
【答案】氯化亚铁 2Al+3FeO![]() Al2O3+3Fe 2Al+2OH-+2H2O=2AlO2-+3H2↑ 不能得出结论,设计实验:取反应后溶液少量于试管中,滴加几滴K3[Fe(CN)6]溶液,若产生蓝色沉淀,则证明有Fe2+产生,证实了Fe3+能氧化单质银
Al2O3+3Fe 2Al+2OH-+2H2O=2AlO2-+3H2↑ 不能得出结论,设计实验:取反应后溶液少量于试管中,滴加几滴K3[Fe(CN)6]溶液,若产生蓝色沉淀,则证明有Fe2+产生,证实了Fe3+能氧化单质银
【解析】
电解熔融状态NaCl得到金属钠和氯气,A为黑色粉末,B为金属单质,A和B在高温下反应,且n(A):n(B)=3:2,得出反应②为2Al+3FeO![]() Al2O3+3Fe,即A为FeO,B为Al,根据转化关系,D为Cl2,C为Na,E为Fe,F为Al,Na与H2O反应生成NaOH和H2,即H为NaOH,Al与NaOH反应生成NaAlO2和H2,即K为NaAlO2,Fe和Cl2反应生成FeCl3,即G为FeCl3,FeCl3与Fe在溶液中反应生成FeCl2,即J为FeCl2,I和Fe反应生成FeCl2和H2,即I为HCl,据此分析作答;
Al2O3+3Fe,即A为FeO,B为Al,根据转化关系,D为Cl2,C为Na,E为Fe,F为Al,Na与H2O反应生成NaOH和H2,即H为NaOH,Al与NaOH反应生成NaAlO2和H2,即K为NaAlO2,Fe和Cl2反应生成FeCl3,即G为FeCl3,FeCl3与Fe在溶液中反应生成FeCl2,即J为FeCl2,I和Fe反应生成FeCl2和H2,即I为HCl,据此分析作答;
I.电解熔融状态NaCl得到金属钠和氯气,A为黑色粉末,B为金属单质,A和B在高温下反应,且n(A):n(B)=3:2,得出反应②为2Al+3FeO![]() Al2O3+3Fe,即A为FeO,B为Al,根据转化关系,D为Cl2,C为Na,E为Fe,F为Al,Na与H2O反应生成NaOH和H2,即H为NaOH,Al与NaOH反应生成NaAlO2和H2,即K为NaAlO2,Fe和Cl2反应生成FeCl3,即G为FeCl3,FeCl3与Fe在溶液中反应生成FeCl2,即J为FeCl2,I和Fe反应生成FeCl2和H2,即I为HCl,
Al2O3+3Fe,即A为FeO,B为Al,根据转化关系,D为Cl2,C为Na,E为Fe,F为Al,Na与H2O反应生成NaOH和H2,即H为NaOH,Al与NaOH反应生成NaAlO2和H2,即K为NaAlO2,Fe和Cl2反应生成FeCl3,即G为FeCl3,FeCl3与Fe在溶液中反应生成FeCl2,即J为FeCl2,I和Fe反应生成FeCl2和H2,即I为HCl,
(1)根据上述分析,J为FeCl2,名称为氯化亚铁;
(2)反应②的化学方程式为2Al+3FeO![]() Al2O3+3Fe;
Al2O3+3Fe;
(3)反应⑤的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
II.Fe3+如果氧化Ag,则会被银还原成Fe2+,通过检验Fe2+的存在可以证明Fe3+能够氧化单质Ag,具体操作为取反应后溶液少量于试管中,滴加几滴K3[Fe(CN)6]溶液,若产生蓝色沉淀,则证明有Fe2+产生,证实了Fe3+能氧化单质银,答案为不能得出结论,设计实验:取反应后溶液少量于试管中,滴加几滴K3[Fe(CN)6]溶液,若产生蓝色沉淀,则证明有Fe2+产生,证实了Fe3+能氧化单质银。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、CaO、SiO2)为原料生产ZnSO4·7H2O的流程如图:

(1)“滤渣A”的主要成分是__。
(2) “反应Ⅰ”中,先加入NaClO反应的离子方程式为__。
(3) “反应Ⅰ”中,再加入NaOH调节合适的pH,则“滤渣B”的主要成分是__(填化学式)。
(4) “反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是__。
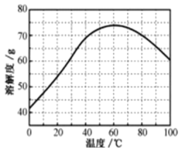
(5)已知ZnSO4溶液的溶解度随温度变化如图,从“滤液”中分离出ZnSO4·7H2O,涉及以下操作:a.在60℃蒸发溶剂;b.蒸发至溶液出现晶膜,停止加热;c.在100℃蒸发溶剂;d.冷却至室温;e.过滤。以上操作的正确顺序为:__(操作可重复使用)。
(6)取28.7g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为___(填字母标号)。
a.ZnSO4·H2O b.ZnSO4c.Zn3O(SO4)2d.ZnO
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用下图A装置制备乙酸乙酯。

(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:______.与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是______.
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管I中的试剂 | 试管II中的试剂 | 有机层的厚度/cm |
A | 2mL乙醇、1mL乙酸 1mL18molL-1浓硫酸 | 饱和Na2CO3 | 3.0 |
B | 2mL乙醇、1mL乙酸 | 0.1 | |
C | 2mL乙醇、1mL乙酸 3mL2molL-1H2SO4 | 0.6 | |
D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是______mL和______molL-1。
②分析实验______(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为______。
(4)为充分利用反应物,甲、乙两位同学分别设计了如图甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为最合理的是______。