题目内容
按图所示实验过程填空:
(1)写出上述反应的离子方程式:
① ;
② ;
③ 。
(2)填空:a b c d 。
(11分)(1)①2Fe2+4Br-+3Cl2=2Fe3++6Cl-+2Br2(3分)②2Fe3++2I-=2Fe2++I2(2分)
③Br2+2I-=2Br-+I2(2分)(2)a 棕黄 b 橙红 c 蓝 d 紫红(各1分)
解析试题分析:(1)①溴离子和亚铁离子均能被氯气氧化,因此向溴化亚铁溶液中通入足量氯气的离子方程式为2Fe2+4Br-+3Cl2=2Fe3++6Cl-+2Br2。
②单质溴易溶在四氯化碳中,且四氯化碳的密度大于水的。因此下层是有机层,溶液呈橙红色;上层是水层含有铁离子,溶液呈棕黄色。铁离子能氧化碘化钾生成单质碘,碘遇淀粉显蓝色,所以反应②的离子方程式为2Fe3++2I-=2Fe2++I2。
③下层含有单质溴,单质溴的氧化性强于单质碘的,能把碘化钾氧化生成单质碘。单质碘易溶在四氯化碳中溶液呈紫红色,所以反应③的离子方程式为Br2+2I-=2Br-+I2。
(2)根据以上分析可知颜色分别是a 棕黄 b 橙红 c 蓝 d 紫红。
考点:考查氧化还原反应方程式的应用与书写、卤素单质的溶解性以及颜色的判断、物质的检验、萃取等

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石( Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
Ⅱ.在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为 。
(2)欲从Na2 SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸和下列选项中的 试剂(填字母代号),
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
再通过 操作方可实现(填实验操作名称)。
②写出Na2BeO2与足量盐酸发生反应的离子方程式: ;
(3)为使Fe3+沉淀完全,须用氨水调节pH =a,则a应控制在
的范围内;继续加氨水调节pH =b发生反应的离子方程式为 ,溶液中Fe3+完全沉淀的判定标准是 。
海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
(1)常温下,海水的pH在7.5~8.6之间,其原因是(用离子方程式表示)______________________________。
(2)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有________和CaCO3,生成CaCO3的离子方程式是_______________。
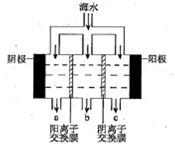
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
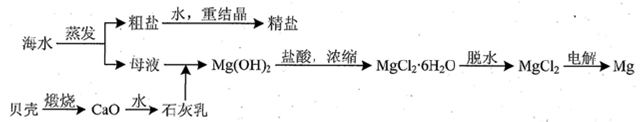
①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是_____。
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是_________________________。
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L。
①饱和Mg(OH)2溶液中滴加酚酞,现象是___________________________。
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量_________,再加入足量NaOH,将Mg2+转为Mg(OH)2。25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为______%[保留2位小数,海水中饱和Mg(OH)2溶液的密度都以l g/cm3计]。
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如下:
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解,产生 沉淀。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入 (填加入物质的化学式),然后 (依此填写实验操作名称)。物质循环使用,能节约资源。上述实验中,可以循环使用的物质是 (填写物质的化学式)。
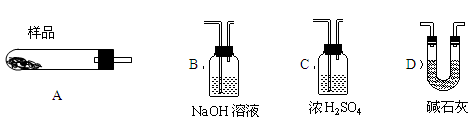
(4)现设计实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值。请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③ ,④ ,⑤MgO称量。
(5)从下列仪器(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置 (选择仪器代号,可重复使用,用“A→B→……→”表示)
(6)18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中a= ,b= ,c= 。
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
(1)硫酸渣的成分中属于两性氧化物的是 , 写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: ;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B可以回收的物质有______________________;
(4)简述洗涤过程的实验操作 ;
(5)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为 (用最简分数表达式表示)。
(已知相对原子质量:O 16 S 32 Fe 56 )
为了达到下列表格中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中。
| 实验要求 | 试剂及方法 |
| 证明明矾水溶液呈酸性 | |
| 鉴别甲烷与乙烯 | |
| 除去MgO中含有的Al2O3 | |
| 鉴别乙醇和乙醛 | |
供选择的化学试剂及实验方法
A.新制的Cu(OH)2
B.加盐酸,过滤
C.将溶液滴在pH试纸上
D.加入过量浓NaOH溶液,过滤
E.酸性KMnO4溶液

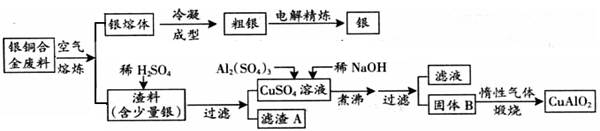
 Cu AlO2 + (系数1也要写).
Cu AlO2 + (系数1也要写).