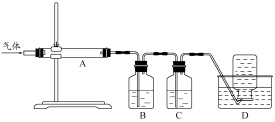
题目内容
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题以此粉末为原料,资源回收的工艺流程如下: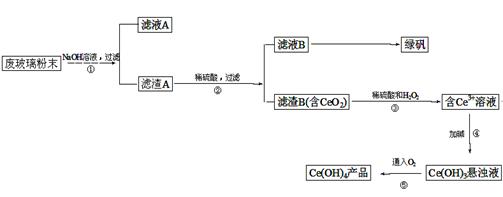
(1)写出第①步反应的离子方程式 。
(2)洗涤滤渣B的目的是为了除去____(填离子符号),检验该离子是否洗净的方法是 。
(3)写出第③步反应的化学方程式_____________________________。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经 、 、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为97%)1.0g,加硫酸溶解后,用0.1000mol/LFeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为 mL。
(1)SiO2+2OH-=SiO32-+H2O(2分)
(2)Fe3+(2分);取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净;否
则未洗净(2分,其他合理答案给分)
(3)2CeO2+ H2O2 + 3H2SO4= 2Ce2(SO4)3 + O2↑+ 4H2O(2分)
(4)蒸发浓缩、冷却结晶(每空1分,共2分)
(5)46.63(2分,需保留小数点后两位)
解析试题分析:这是一道常见的物质提纯的题。(1)加入强碱是为了除去其中的二氧化硅;(2)洗涤滤渣的目的是为了除去三价铁离子;用硫氰化钾来检验是否除净了三价铁离子;(3)这一步是用过氧化氢来还原二氧化铈,二氧化铈被还原为正三价,过氧化氢被氧化为氧气;(4)结晶的过程总是得蒸发浓缩冷却结晶;
(5)2Ce(OH)4+2FeSO4+4H2SO4=Ce2(SO4)3 + Fe2(SO4)3+11H2O
416g 2mol
0.97g 
416g× =0.97g×2mol
=0.97g×2mol
解之得:V=46.63 mL
考点:以工艺流程为基础,考察化学实验基本操作、元素及化合物知识、化学计算、氧化还原反应等相关知识

工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: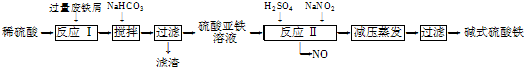
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为 ___。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____ ____。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下: ① NaBr+H2SO4 = HBr+NaHSO4;②R-OH+HBr R-Br+H2O
R-Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下
| | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴代烃的水溶性 (填“大于”、“等于”或“小于”)相应的醇;其原因是 。
(2)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层”、“下层”或“不分层”)。
(3)制备操作中,加入的浓硫酸必须进行稀释,目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 ;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是 。
从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2等)中回收V2O5的一种生产工艺流程示意图如下,请回答下列问题: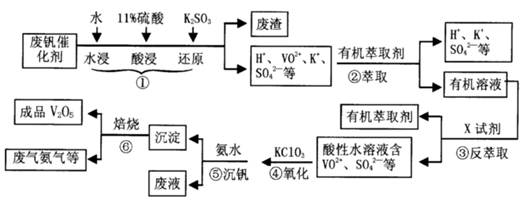
(1)步骤①中废渣的主要成分是 ,③中X试剂为 。
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是 。
(3)②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)。
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是 。
2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是 。
(4)请完成④中的反应离子方程式:
□ClO3- + □VO2+ +□H+ =□VO3+ + □ +□
(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH值为 。
(6)该工艺流程中,可以循环利用的物质有 。

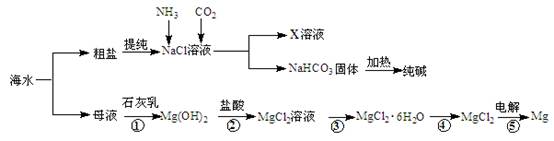
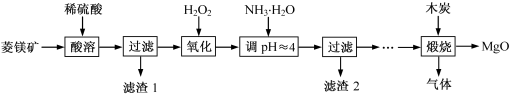
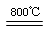 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑