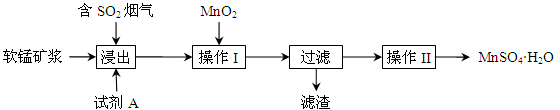
题目内容
稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石( Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下: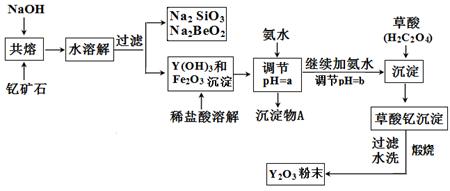
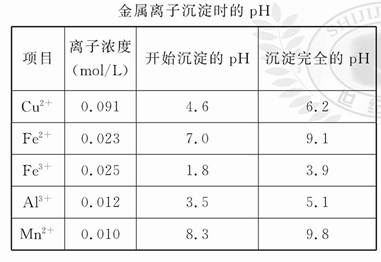
已知:I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
Ⅱ.在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为 。
(2)欲从Na2 SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸和下列选项中的 试剂(填字母代号),
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
再通过 操作方可实现(填实验操作名称)。
②写出Na2BeO2与足量盐酸发生反应的离子方程式: ;
(3)为使Fe3+沉淀完全,须用氨水调节pH =a,则a应控制在
的范围内;继续加氨水调节pH =b发生反应的离子方程式为 ,溶液中Fe3+完全沉淀的判定标准是 。
(1)Y2O3·FeO·2BeO·2SiO2 (2分)
(2)①b(2分),过滤 (1分) ②BeO22-+4H+=Be2++2H2O(2分)
(3)3.7<a<6.0 (2分) Y3++3NH3·H2O=Y(OH)3↓+3NH4+(2分)
当溶液中c(Fe3+)<10-5mol/L时,则可判定Fe3+完全沉淀(1分)
解析试题分析:(1)依据元素化合价和原子守恒书写元素的氧化物组成,所以钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为Y2O3·FeO·2BeO·2SiO2
(2)①周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似,Be(OH)2与Al(OH)3相似,具有两性,加过量的盐酸,硅酸钠反应生成硅酸沉淀,Na2BeO2的反应生成氯化铍溶液,再加入过量氨水沉淀铍离子,故答案为:b;分离难溶的固体与溶液的操作为过滤。
②Na2BeO2与足量盐酸生成BeCl2、NaCl和H2O,所以离子方程式为:BeO22-+4H+=Be2++2H2O
(3)三价铁离子开始沉淀到沉淀完全的PH范围为:2.7-3.7;钇离子开始沉淀和沉淀完全的PH为:6.0-8.2,所以使Fe3+沉淀完全,须用氨水调节pH=a的范围为:3.7<a<6.0;继续加氨水调节pH=b发生反应的离子方程式为:Y3++3NH3?H2O=Y(OH)3↓+3NH4+;当离子浓度<10-5mol/L时,则可说明离子已沉淀完全,所以当溶液中c(Fe3+)<10-5mol/L时,则可判定Fe3+完全沉淀。
考点:本题考查物质组成的表达式、基本操作和试剂的选择、离子方程式的书写、物质分离试验方法设计,离子分离和离子检验的实验操作。

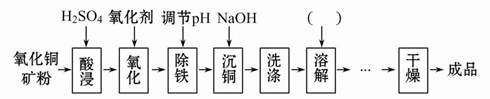
卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图: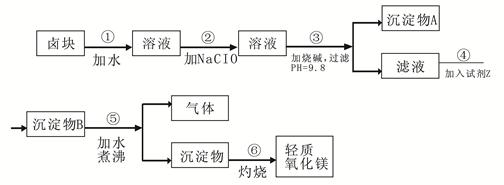
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
表2 化学试剂价格表
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2 ,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
(1)在步骤②中加入漂液而不是双氧水其原因是 。
写出加入NaClO发生反应的离子方程式 。
(2)在步骤③中控制pH=9.8,其目的是 。
(3)沉淀物A的成分为 ,试剂Z应该是 。
(4)在步骤⑤中发生反应的化学方程式是 。
(5)若在实验室中完成步骤⑥,则沉淀物必需在 (填仪器名称)中灼烧。
高铁酸钾(K2FeO4)是新型多功能水处理剂,碱性条件下性质稳定,其生产过程如下: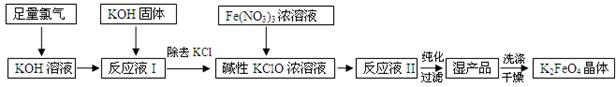
请回答下列问题
(1)氯碱工业制Cl2的化学反应方程式 ;
(2)生成“反应液Ⅱ”的离子方程式是 ;(3)使用碱性KClO的原因是 ;
(4)从“反应液II”中分离出K2FeO4后 ,副产品是KCl和 (填化学式),该混合物可用 方法分离提纯(填字母序号);
| A.过滤 | B.分液 | C.蒸馏 | D.重结晶 |