题目内容
9.有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性;同体积、同物质的量浓度的HB、HC用样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为HA>HC>HB>HD.分析 酸的酸性越强,酸根离子水解程度越小,相同浓度的钠盐溶液,酸根离子水解程度越大其钠盐溶液pH越大;
强酸强碱盐溶液呈中性;溶液导电能力与溶液中离子浓度成正比,据此判断四种酸的酸性强弱.
解答 解:酸的酸性越强,酸根离子水解程度越小,相同浓度的钠盐溶液,酸根离子水解程度越大其钠盐溶液pH越大,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,说明酸性强弱:HB>HD;
强酸强碱盐溶液呈中性,强碱弱酸盐溶液呈碱性,NaA溶液呈中性,说明HA为强酸;
溶液导电能力与溶液中离子浓度成正比,同体积、同物质的量浓度的HB、HC用样的装置分别作导电性试验,发现后者的灯泡比前者亮,说明HC溶液中离子浓度大于HB,且二者浓度相等,所以酸性:HC>HB,
通过以上分析知,这四种酸强弱顺序是HA>HC>HB>HD,
故答案为:HA>HC>HB>HD.
点评 本题考查酸性强弱判断,明确酸的酸性强弱与酸根离子水解程度的关系是解本题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示.下列有关说法不正确的是( )


| A. | M与A均能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | B能发生消去、氧化、取代、缩聚等反应 | |
| C. | 1molM与足量烧碱溶液反应,可消耗2nmolNaOH | |
| D. | A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
17. 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
(1)二氧化碳重整可用于制取甲烷.已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
则反应CO2(g)+4H2(g)?CH4(g)+2H2(g)的△H3-163kJ/mol.
(2)一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向正反应方向移动.
②在700K、起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,H2的转化率为40%.若达到平衡后H2的浓度为amol•L-1,则达到平衡时CH2CH2OH的浓度为$\frac{a}{9}$mol/L.
(3)CO2和H2在一定条件下可合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+2H2O(g)△H.在一定压强下,将2.5molH2与amolCO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据如下表:
①x、y的大小关系为B.
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0 B.该反应的平衡常数随温度升高而减小
C.转化率分别为z、w时,达到平衡的时间前者长 D.转化率分别为y、w时,平衡常数不同.
 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷.已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
则反应CO2(g)+4H2(g)?CH4(g)+2H2(g)的△H3-163kJ/mol.
(2)一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向正反应方向移动.
②在700K、起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,H2的转化率为40%.若达到平衡后H2的浓度为amol•L-1,则达到平衡时CH2CH2OH的浓度为$\frac{a}{9}$mol/L.
(3)CO2和H2在一定条件下可合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+2H2O(g)△H.在一定压强下,将2.5molH2与amolCO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据如下表:
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0 B.该反应的平衡常数随温度升高而减小
C.转化率分别为z、w时,达到平衡的时间前者长 D.转化率分别为y、w时,平衡常数不同.
18. 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )| A. | 反应在前50s的平均速率v(PCl5)=0.0032 mol•L-1•s-1 | |
| B. | 该反应的平衡常数K=0.025 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3 和0.20mol Cl2,反应达到平衡前v(正)>v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时:c(PCl3)=0.11mol•L-1,则反应的△H<0 |
19.已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中正确的是( )


| A. | 由红外光谱可知,该有机物的结构简式为CH3OH | |
| B. | 由核磁共振氢谱可知,该有机物分子中有3个氢原子 | |
| C. | 综合上述两种谱图分析,可以得知其A的相对分子质量 | |
| D. | 若A的化学式为C2H6O,则其结构简式为CH3CH2OH |
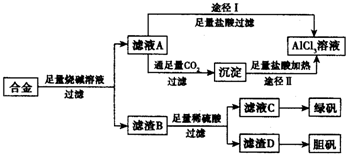 工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题:
工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题:
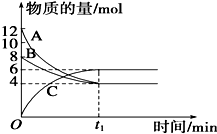 某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析: