题目内容
(1)80℃时,将0.40 mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 (g)  2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
①上表中c =___________;e =_____________
②计算20s—40s内用NO2表示的平均反应速率为 mol/(L·s)
③计算在80℃时该反应的平衡常数K= ;
(2)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4,此时,平衡朝_______方向移动;建立新平衡后,N2O4的转化率_______75%(填“>、<或=”);
(3)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4和0.1mol NO2时,v正________ v逆(填“>、<或=”)
 2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 110 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②计算20s—40s内用NO2表示的平均反应速率为 mol/(L·s)
③计算在80℃时该反应的平衡常数K= ;
(2)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4,此时,平衡朝_______方向移动;建立新平衡后,N2O4的转化率_______75%(填“>、<或=”);
(3)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4和0.1mol NO2时,v正________ v逆(填“>、<或=”)
(10分)
(1)① 0.14; 0.10 (各1分)
② 0.002 (2分)
③ 1.8 (2分)
(2)正; < (各1分)
(3) > (2分)
(1)① 0.14; 0.10 (各1分)
② 0.002 (2分)
③ 1.8 (2分)
(2)正; < (各1分)
(3) > (2分)
试题分析:(1)①根据物质发生化学反应的物质的量之比等于化学计量数之比进行计算,c =0.14; e =0.10。
②当20s时,生成二氧化氮0.24mol,则消耗四氧化二氮0.12mol,容器中还剩余0.40mol-0.12mol=0.28mol;
v=△n /(V△t=(0.28-0.20)mol/(2L×20s)=0.0020mol/(L.s)
故答案为:0.0020。
③当到达80s时,二氧化氮的物质的量不再变化,所以反应达到平衡状态,二氧化氮的物质的量是0.60mol,则消耗四氧化二氮的物质的量是0.30mol,还剩余0.10mol,即d=e=0.10mol.
二氧化氮的平衡浓度=0.60mol/2L=0.30mol/L,
四氧化二氮的平衡浓度=0.10mol/2L=0.05mol/L,
K= C2(NO2)/C(N2O4)= (0.30mol/L)2/0.05mol/L=1.8mol?L-1
故答案为:1.8。
点评:本题考查了化学平衡的计算和外界条件对化学平衡的影响,难度不大,注意化学平衡常数只与温度有关,与其它任何物理量都无关。

练习册系列答案
相关题目
 5Ca2+ +3PO43― +OH―当糖附在牙齿上发酵时会产生H+,试运用化学平衡理论说明经常吃糖对牙齿的影响。
5Ca2+ +3PO43― +OH―当糖附在牙齿上发酵时会产生H+,试运用化学平衡理论说明经常吃糖对牙齿的影响。 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是 
 cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是 ( )
cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是 ( ) 2AB(g) 在一定条件下,达到平衡状态的标志是( )
2AB(g) 在一定条件下,达到平衡状态的标志是( ) C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是  2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示: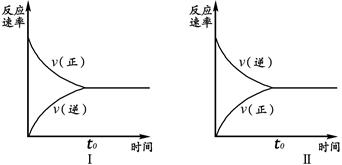
 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示可得出的判断结论正确的是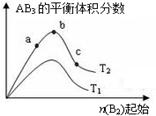
 2NO2(g) 在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
2NO2(g) 在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是