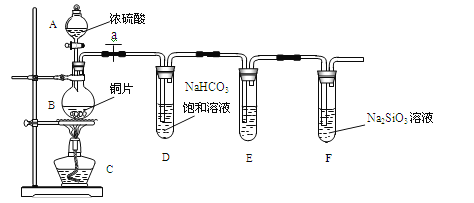
题目内容
【题目】25℃时,5 mL 0.1 mol /L的 H2SO4和15 ml 0.1 mol/L的NaOH溶液相混合,并稀释至500 ml,最后所得溶液的pH为( )
A.12.3 B.11 C.3 D.1.7
【答案】B
【解析】
试题分析:5mL0.1molL-1 H2SO4中氢离子的物质的量为:5×10-3L×0.1mol/L×2=1×10-3mol,15mL0.1molL-1 NaOH 溶液中含有的氢氧根离子的物质的量为:15×10-3L×0.1mol/L=1.5×10-3mol,两溶液混合后,氢氧化钠过量,剩余的氢氧根离子的物质的量为:1.5×10-3mol-1×10-3mol=5×10-4mol,稀释至500mL后溶液中氢氧根离子的浓度为:c(OH-)=![]() mol/L=1×10-3mol/L,常温下溶液中氢离子浓度为:c(H+)=
mol/L=1×10-3mol/L,常温下溶液中氢离子浓度为:c(H+)=![]() mol/L=1×10-11mol/L,稀释后溶液的pH=-lg c(H+)=lg1×10-11=11,故选B。
mol/L=1×10-11mol/L,稀释后溶液的pH=-lg c(H+)=lg1×10-11=11,故选B。

【题目】[化学-选修3:物质结构与性质]
铁氧体是一种磁性材料,具有广泛的应用。 -
(1)基态铁原子的核外电子排布式为[Ar]_______。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2 ]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是____________;醋酸钠中碳原子的杂化类型是_________。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较下表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因________。
N2H4 | NH3 | |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
(4)下图是从铁氧体离子晶体Fe3O4中,取出的能体现其晶体结构的一个立方体,则晶体中的氧离子是否构成了面心立方最密堆积______(填“是”或“否”),该立方体是不是Fe3O4的晶胞______(填“是”或“否”),立方体中三价铁离子处于氧离子围成的_____空隙(填空间结构)。
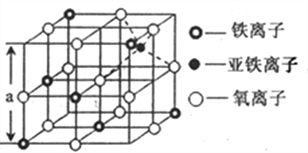
(5)解释该Fe3O4晶体能导电的原因________,根据上图计算Fe3O4晶体的密度_____gcm-3。 (图中a=0.42nm,计算结果保留两位有效数字)