题目内容
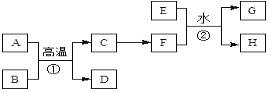
【题目】中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转换关系(部分产物未列出),单质A常作为食品包装材料,甲是两性氧化物。
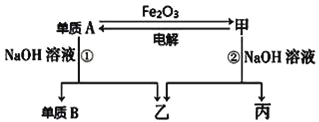
根据图示转化关系回答:
(1)写出反应①的离子方程式:_________________。
(2)实验室完成单质A与Fe2O3反应实验,需要的试剂还有_______。
a.KCl b.KClO 3 c.MnO2 d.Mg
(3)利用该反应的原理,工业上可用于___________。
【答案】2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ bd 焊接钢轨等
【解析】
单质A常作为食品包装材料,甲是两性氧化物,A与氧化铁反应得到甲,且A能与NaOH反应,则A为Al,甲为Al2O3,单质B为H2,乙为NaAlO2,丙为H2O,据此解答。
根据以上分析可知A为Al,B为H2,甲为Al2O3,乙为NaAlO2,丙为H2O,则
(1)反应①是铝与氢氧化钠溶液反应,反应的离子方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(2)A为金属Al,单质A与Fe2O3反应为铝热反应,铝热反应需要引发剂引发高温反应,镁条在空气中可以燃烧,氧气是氧化剂,但插入混合物中的部分镁条燃烧时,氯酸钾则是氧化剂,以保证镁条的继续燃烧,同时放出足够的热量引发氧化铁和铝粉的反应,即需要的试剂还有镁条和氯酸钾,答案选bd;由于该反应能放出大量的热,使铁熔化,则利用该反应的原理,工业上可用于焊接钢轨等。

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目