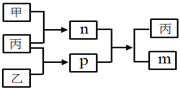
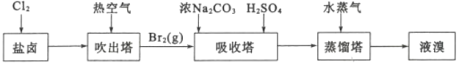
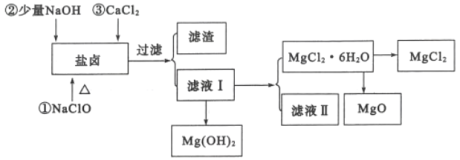
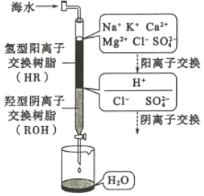
题目内容
【题目】甲醇是重要的化工原料。利用合成气(主要成分为(CO,CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
ii:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
iii:CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应2中相关化学键键能数据如下:
化学键 | H—H | C=O | C≡O | H—O |
E/KJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=___kJ·mol-1。已知ΔH1=-63kJ·mol-1,则ΔH3=___kJ·mol-1。
(2)对于反应1,不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,请回答下列问题:
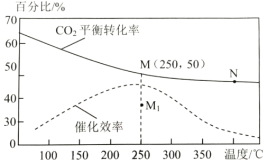
①下列说法不正确的是(__________)
A.M点时平衡常数比N点时平衡常数大
B.温度低于250℃时,随温度升高甲醇的平衡产率降低
C.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
②若在刚性容器中充入3molH2和1molCO2发生反应1,起始压强为4MPa,则图中M点CH3OH的体积分数为___,250℃时反应的平衡常数Kp=___(MPa)-2(保留三位有效数字);
③若要进一步提高甲醇产率,可采取的措施有___(写两条即可)
(3)相同条件下,一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲醇生成速率,结合反应1、2分析原因:___。
(4)以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
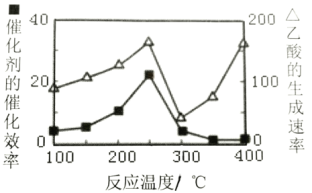
250~300℃时,乙酸的生成速率降低的主要原因是___。
300~400℃时,乙酸的生成速率升高的主要原因是___。
【答案】+36 +99 CD 16.7%或![]() 0.148 增大压强、及时移走生成物、降低温度、增大氢气投料比、换更优催化剂 CO的存在促使反应ⅱ平衡逆向移动;水蒸气的量减少,促使反应ⅰ平衡正向移动 催化剂的催化效率降低 温度升高对反应速率影响为主要因素
0.148 增大压强、及时移走生成物、降低温度、增大氢气投料比、换更优催化剂 CO的存在促使反应ⅱ平衡逆向移动;水蒸气的量减少,促使反应ⅰ平衡正向移动 催化剂的催化效率降低 温度升高对反应速率影响为主要因素
【解析】
(1)根据焓变=反应物键能之和-生成物键能之和,可得CO2(g)+H2(g)CO(g)+H2O(g)△H2;根据盖斯定律可得CH3OH(g)CO(g)+2H2(g)的△H3;
(2) ①反应焓变小于零为放热反应,温度越高平衡常数越小,催化剂可以加快反应的速率,但不影响平衡移动;化工生产时,既要考虑反应速率又要考虑转化率或产率的双重影响,以此来选择化工生产的适宜条件;
②初始投料为3molH2和1molCO2,M点CO2的转化率为50%,恒容容器中气体的体积分数即物质的量分数,则列三段式进行相关计算;恒温恒容条件下,气体的压强之比等于物质的量之比,初始气体的总物质的量为4mol,压强为4MPa,则平衡时气体的总物质的量为3mol,压强为3MPa,据平衡时各物质的分压带入平衡常数计算公式进行计算;
③该反应气体减少的反应,增大压强、及时移走生成物使平衡正向移动;该反应为放热反应,降低温度、增大氢气投料比、换更优催化剂都可以提高甲醇的产率;
(3)CO的存在促使反应ⅱ平衡逆向移动;水蒸气的量减少,促使反应ⅰ平衡正向移动,所以一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲醇生成速率;
(4)250~300℃时,催化剂的催化效率降低,所以乙酸的生成速率降低;300~400℃时,温度升高对反应速率影响为主要因素,所以乙酸的生成速率升高。
(1)根据焓变=反应物键能之和-生成物键能之和,可得CO2(g)+H2(g)CO(g)+H2O(g)△H2=803×2kJ/mol+436kJ/mol-1076kJ/mol-2×465kJ/mol=+36kJ/mol;
已知①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=-63kJmol-1,②CO2(g)+H2(g)CO(g)+H2O(g)△H2=+36kJ/mol根据盖斯定律反应②-反应①得到③CH3OH(g)CO(g)+2H2(g)的△H3=+99kJ/mol;
(2)①A.反应焓变小于零为放热反应,温度越高平衡常数越小,所以M点平衡常数大于N点平衡常数,故A正确;
B.据图可知温度低于250℃时,随温度升高CO2的平衡转化率下降,即平衡逆向移动,所以甲醇的平衡产率降低,故B正确;
C.温度相同平衡常数不变,不改变投料的情况下,即使不使用催化剂,CO2的平衡转化率也位于M点,故C错误;
D.虽然该反应为放热反应,降低温度可以增大CO2的平衡转化率,但温度过低反应速率会很慢,单位时间内CO2的转化率降低,所以不能在较低温度下进行,故D错误;
综上所述答案为CD;
②初始投料为3molH2和1molCO2,M点CO2的转化率为50%,则列三段式有:

恒容容器中气体的体积分数即物质的量分数,所以CH3OH的体积分数为![]() =16.7%或
=16.7%或![]() ;恒温恒容条件下,气体的压强之比等于物质的量之比,初始气体的总物质的量为4mol,压强为4MPa,则平衡时p(CO2)=p(CH3OH) =p(H2O)=0.5MPa,p(H2)=1.5MPa,则Kp=
;恒温恒容条件下,气体的压强之比等于物质的量之比,初始气体的总物质的量为4mol,压强为4MPa,则平衡时p(CO2)=p(CH3OH) =p(H2O)=0.5MPa,p(H2)=1.5MPa,则Kp=![]() =0.148;
=0.148;
③该反应气体减少的反应,增大压强可以使平衡正向移动提高甲醇的产率;及时移走生成物使平衡正向移动也可以增大甲醇的产率;该反应焓变小于零为放热反应,降低温度可以使平衡正向移动从而提高甲醇的产率;增大氢气投料比、换更优催化剂都可以提高甲醇的产率;
(3)CO的存在促使反应ⅱ平衡逆向移动;水蒸气的量减少,促使反应ⅰ平衡正向移动,所以一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲醇生成速率;
(4)250~300℃时,催化剂的催化效率降低,所以乙酸的生成速率降低;300~400℃时,温度升高对反应速率影响为主要因素,所以乙酸的生成速率升高。