题目内容
【题目】短周期元素X、Y、Z原子序数之和为16,原子半径大小为r(Y)>r(X)>r(Z),它们的常见单质在适当条件下可发生如图变化,其中B和C均为10电子分子。下列说法不正确的是( )

A.X与Z形成的某种化合物可用来杀菌消毒
B.自然界中X单质与Y单质不能发生化学反应
C.B和C分子间因形成氢键而使C极易溶于B中
D.A和C一定条件下能发生氧化还原反应
【答案】B
【解析】
常见的10电子分子有CH4、NH3、H2O、HF,则Z单质一定为H2,Z为H;X、Y、Z原子序数之和为16,则X、Y原子序数只和=16-1=15,原子半径大小为r(Y)>r(X)>r(Z),X、Y分别为O、N或F、C,且X单质能和Y单质反应,则X、Y确定为O、N;综上所述,X、Y、Z分别为:O、N、H,A为NO,B为H2O,C为NH3,据此解答。
A.X(O)与Z(H)形成的H2O2有强氧化性,能使细菌的蛋白质变性,可用来杀菌消毒,A正确;
B.自然界中的X单质(O2)与Y单质(N2)在放电的条件下能反应生成NO,B错误;
C.B为H2O,C为NH3,H2O和NH3分子间容易形成氢键而使NH3极易溶于H2O中,C正确;
D.A为NO,有一定氧化性,C为NH3,有较强还原性,一定条件下能发生氧化还原反应,D正确。
答案选B。

【题目】甲醇是重要的化工原料。利用合成气(主要成分为(CO,CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
ii:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
iii:CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应2中相关化学键键能数据如下:
化学键 | H—H | C=O | C≡O | H—O |
E/KJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=___kJ·mol-1。已知ΔH1=-63kJ·mol-1,则ΔH3=___kJ·mol-1。
(2)对于反应1,不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,请回答下列问题:
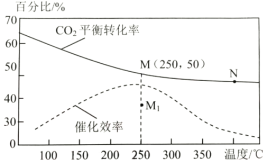
①下列说法不正确的是(__________)
A.M点时平衡常数比N点时平衡常数大
B.温度低于250℃时,随温度升高甲醇的平衡产率降低
C.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
②若在刚性容器中充入3molH2和1molCO2发生反应1,起始压强为4MPa,则图中M点CH3OH的体积分数为___,250℃时反应的平衡常数Kp=___(MPa)-2(保留三位有效数字);
③若要进一步提高甲醇产率,可采取的措施有___(写两条即可)
(3)相同条件下,一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲醇生成速率,结合反应1、2分析原因:___。
(4)以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:

250~300℃时,乙酸的生成速率降低的主要原因是___。
300~400℃时,乙酸的生成速率升高的主要原因是___。