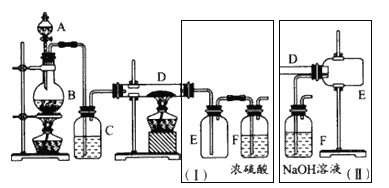
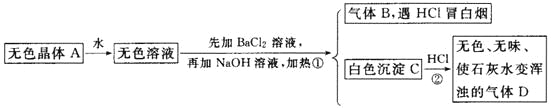
题目内容
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.氢离子的数目减少
B.溶液中![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
【答案】B
【解析】
根据醋酸是弱电解质,则室温下向10mLpH=3的醋酸溶液中加水稀释将促进电离,离子的数目增多,但溶液的体积增大,则电离产生的离子的浓度减小。
A.加水稀释时,促进电离,则溶液中导电粒子的数目增多,故A错误;
B. ![]() =Ka/Kw,因为电离常数与水的离子积常数只与温度有关,温度一定时,溶液中
=Ka/Kw,因为电离常数与水的离子积常数只与温度有关,温度一定时,溶液中![]() 不变,故B正确;
不变,故B正确;
C.加水稀释时,有更多的醋酸分子发生电离,所以醋酸的电离程度增大,但溶液体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,故C错误;
D.等体积10mLpH=3的醋酸与pH=11的NaOH溶液混合时,因为醋酸为弱电解质,因此醋酸的浓度大于0.001mol/L,中和后醋酸过量,故反应后溶液显酸性,pH<7,D错误;
答案:B

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醇是重要的化工原料。利用合成气(主要成分为(CO,CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
ii:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
iii:CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应2中相关化学键键能数据如下:
化学键 | H—H | C=O | C≡O | H—O |
E/KJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=___kJ·mol-1。已知ΔH1=-63kJ·mol-1,则ΔH3=___kJ·mol-1。
(2)对于反应1,不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,请回答下列问题:
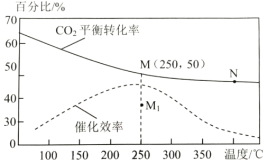
①下列说法不正确的是(__________)
A.M点时平衡常数比N点时平衡常数大
B.温度低于250℃时,随温度升高甲醇的平衡产率降低
C.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
②若在刚性容器中充入3molH2和1molCO2发生反应1,起始压强为4MPa,则图中M点CH3OH的体积分数为___,250℃时反应的平衡常数Kp=___(MPa)-2(保留三位有效数字);
③若要进一步提高甲醇产率,可采取的措施有___(写两条即可)
(3)相同条件下,一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲醇生成速率,结合反应1、2分析原因:___。
(4)以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
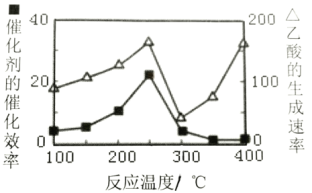
250~300℃时,乙酸的生成速率降低的主要原因是___。
300~400℃时,乙酸的生成速率升高的主要原因是___。