题目内容
下列说法错误的是( )
| A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构 |
| B.1 mol金刚石晶体中,平均含有2 mol C—C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如右图所示,该气态团簇分子的分子式为EF或FE |
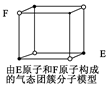
D
解析试题分析:根据等电子体的概念可知选项A正确;金刚石中碳原子形成空间网状的正四面体结构,故B正确。选项C显然是正确的。选项D中强调该物质是气态团簇分子,即是一个大分子,因此不能用均摊法计算,直接找出分子中原子个数即得化学式,该物质的化学式应为(EF)4,选项D错。
考点:物质结构与性质。
点评:属于较简单题

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
如表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是( )
|
如图为元素周期表中短周期的一部分,下列说法错误的是( )
| X | Y |
| Z | W |
| A、Z的原子序数可能是X的两倍 |
| B、单质的活泼性可能是Y<Z |
| C、X、Z的最高价氧化物对应水化物可能均为强酸 |
| D、分别由Y、W形成的单质可能都是原子晶体 |
化学反应原理中涉及很多常数,下列说法错误的是( )
A、反应N2(g)+3H2(g)
| |||||
| B、化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响 | |||||
| C、对于弱电解质的电离平衡常数,当温度一定时,电离平衡常数越小,其酸性越强 | |||||
| D、将AgNO3溶液和KCl溶液混合后,若c(Ag+)?c(Cl-)<KSP(AgCl),则溶液中无沉淀生成 |
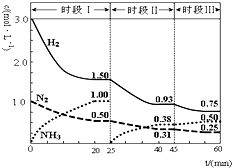 N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示.下列说法错误的是( )
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示.下列说法错误的是( )| A、前20分钟反应物的转化率为50% | B、第25分钟改变的条件是将NH3从反应体系中分离出去 | C、时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数增大 | D、若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |