题目内容
【题目】下列解释事实的离子方程式正确的是
A.向NaClO溶液中通入少量CO2制取次氯酸:ClO-+H2O+CO2=HClO+HCO3-
B.电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-=Fe3++NO↑+2H2O
【答案】A
【解析】
A.次氯酸的酸性强于碳酸氢根弱于碳酸,所以即便少量二氧化碳通入次氯酸钠溶液也只能生成碳酸氢根,离子方程式为ClO-+H2O+CO2=HClO+HCO3-,故A正确;
B.镁离子会和氢氧根生成沉淀,正确离子方程式为2H2O+Mg2++2Cl-![]() Mg(OH)2↓+H2↑+Cl2↑,故B错误;
Mg(OH)2↓+H2↑+Cl2↑,故B错误;
C.Ca(HCO3)2溶液中加入足量的NaOH溶液,碳酸氢根完全反应,离子方程式为Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故C错误;
D.铁和稀硝酸反应制得浅绿色溶液,说明铁过量生成Fe2+,离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故D错误;
故答案为A。

【题目】实验室用浓硫酸和乙醇反应制备乙稀,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量)。请回答下列问题:
(1)试分析CO2和SO2 是怎么样产生的?_____(用一句话说明)。
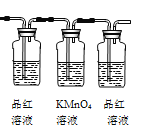
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g) ,按气流的方向,各装置的连接顺序是:__________。
① |
② |
③ |
④ |
(3)实验时若观察到:①中A瓶中溶液褪色,B瓶中深水颜色逐渐变浅,C瓶中溶液不褪色,则A瓶的作用是___________,B瓶的作用是________, C瓶的作用是____________。
(4)装置②中所加的试剂名称是__________,它可以验证的气体是__________,简述确定装置②在整套装置中的位置的理由是______________。
(5)装置③中所盛溶液的名称是__________,它可以用来验证的气体是__________。
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L