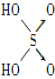题目内容
【题目】硫酸锰是一种植物合成叶绿素的催化剂,也可用于制备多种含锰物质。
回答下列问题:
⑴工业上可用惰性电极电解MnSO4溶液的方法制备MnO2,其阳极的电极反应式为________。
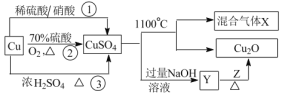
⑵我国普遍采用两矿加酸法制备MnSO4。两矿指软锰矿(主要成分MnO2,含少量Al2O3和SiO2)、黄铁矿(FeS2)。生产MnSO4的工艺流程如下:
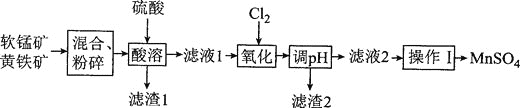
①软锰矿和黄铁矿需按一定比例混合,若黄铁矿过量太多,将导致的主要后果为________。
②“酸溶”时,黄铁矿被氧化为Fe3+、SO42-的离子方程式为________,该操作需控制在90℃,温度不能过低的原因为________。
③若使“氧化”的溶液中杂质离子除净,“调pH”应不小于________![]() 保留两位有效数字
保留两位有效数字![]() 。已知:Mn(OH)2、Al(OH)3、Fe(OH)3的Ksp分别为2.0×10-13、1.0×10-33、4.0×10-38,溶液中离子浓度小于等于10-5 mol·L-1时,认为该离子沉淀完全。
。已知:Mn(OH)2、Al(OH)3、Fe(OH)3的Ksp分别为2.0×10-13、1.0×10-33、4.0×10-38,溶液中离子浓度小于等于10-5 mol·L-1时,认为该离子沉淀完全。
④MnSO4的溶解度曲线如图所示,则“操作I”,为________、________、用热水洗涤、干燥。

⑶用(NH4)2S2O8溶液鉴别溶液中Mn2+的现象为溶液变为紫红色。所发生反应中氧化剂和还原剂的物质的量之比为________。S2O82-中含有1个过氧键。则其中S元素的化合价为________。
【答案】Mn2+ + 2H2O -2e- = MnO2+ 4H+ “酸溶”时过量的黄铁矿消耗过多的硫酸且生成污染性气体H2S 15MnO2 + 2FeS2 + 28H+ ![]() 15 Mn2+ + 2Fe3+ + 4 SO42-+ 14H2O 温度过低时反应速率慢,“酸溶”不充分 4.7 蒸发结晶 趁热过滤 5:2 +6
15 Mn2+ + 2Fe3+ + 4 SO42-+ 14H2O 温度过低时反应速率慢,“酸溶”不充分 4.7 蒸发结晶 趁热过滤 5:2 +6
【解析】
⑴由信息,阳极上Mn2+失电子生成MnO2;
⑵①酸溶时,若黄铁矿过量太多,将导致消耗过多的硫酸且生成污染性气体H2S;②由信息和氧化还原反应原理写出离子方程式;温度过低时反应速率慢,“酸溶”不充分;③由信息,当Al3+沉淀完全时,Fe3+已沉淀完全,根据溶度积进行计算;
④由图知,从MnSO4溶液中分离出MnSO4的操作为蒸发结晶、趁热过滤、用热水洗涤、干燥;
⑶根据化合价升降和得失电子守恒得出氧化剂和还原剂的物质的量;S2O82-中含有1个过氧键,根据化合价计算;
⑴由信息,阳极上Mn2+失电子生成MnO2,电极反应式为Mn2+ + 2H2O -2e- = MnO2+ 4H+;故答案为:Mn2+ + 2H2O -2e- = MnO2+ 4H+;
⑵①由流程图中信息知,两矿混合、粉碎后,用硫酸进行“酸溶”,若黄铁矿过量太多,将导致的主要后果为“酸溶”时过量的黄铁矿消耗过多的硫酸且生成污染性气体H2S;故答案为:“酸溶”时过量的黄铁矿消耗过多的硫酸且生成污染性气体H2S;
②由信息,“酸溶”时发生反应的离子方程式为15MnO2 + 2FeS2 + 28H+ ![]() 15 Mn2+ + 2Fe3+ + 4 SO42-+ 14H2O;该操作需控制在90℃,温度过低时反应速率慢,“酸溶”不充分;故答案为:15MnO2 + 2FeS2 + 28H+
15 Mn2+ + 2Fe3+ + 4 SO42-+ 14H2O;该操作需控制在90℃,温度过低时反应速率慢,“酸溶”不充分;故答案为:15MnO2 + 2FeS2 + 28H+ ![]() 15 Mn2+ + 2Fe3+ + 4 SO42-+ 14H2O;温度过低时反应速率慢,“酸溶”不充分;
15 Mn2+ + 2Fe3+ + 4 SO42-+ 14H2O;温度过低时反应速率慢,“酸溶”不充分;
③由信息,当Al3+沉淀完全时,Fe3+已沉淀完全,溶液中的![]() ,c(OH-) = 5×10-10 mol·L-1,c(H+) = 2×10-5 mol·L-1,pH =4.7,则“调pH”应不小于4.7;故答案为:4.7;
,c(OH-) = 5×10-10 mol·L-1,c(H+) = 2×10-5 mol·L-1,pH =4.7,则“调pH”应不小于4.7;故答案为:4.7;
④由图知,从MnSO4溶液中分离出MnSO4的操作为蒸发结晶、趁热过滤、用热水洗涤、干燥;故答案为:蒸发结晶;趁热过滤;
⑶由信息,(NH4)2S2O8将Mn2+氧化为MnO4-,Mn的化合价从+2价升高到+7价,本身被还原为SO42-,S的化合价从+7价降低到+6价,根据得失电子守恒知,氧化剂和还原剂的物质的量之比为5:2;S2O82-中含有1个过氧键,则-2×6+(-1×2)+2x =-2,解得x=6;故答案为:5:2;+6。

 阅读快车系列答案
阅读快车系列答案【题目】氯化亚铜![]() ,白色、易被氧化,
,白色、易被氧化,![]() 广泛用作催化剂、媒染剂、脱色剂等。工业上用初级铜矿粉
广泛用作催化剂、媒染剂、脱色剂等。工业上用初级铜矿粉![]() 主要含
主要含![]() 、CuS、
、CuS、![]() 、FeO等
、FeO等![]() 制备活性CuCl的流程如下:
制备活性CuCl的流程如下:
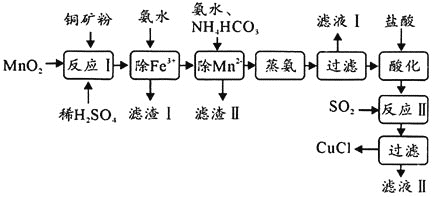
(1)滤渣Ⅰ是![]() 和单质硫的混合物,反应Ⅰ中
和单质硫的混合物,反应Ⅰ中![]() 参与反应的化学方程式为:
参与反应的化学方程式为:![]() 未配平
未配平![]() ,氧化产物为________。
,氧化产物为________。
(2)除![]() 时得
时得![]() 沉淀,该反应的离子方程式为________。
沉淀,该反应的离子方程式为________。
(3)已知![]() 可溶于氨水形成深蓝色溶液:
可溶于氨水形成深蓝色溶液:![]() 。蒸氨条件及蒸氨效果见下表:
。蒸氨条件及蒸氨效果见下表:
序号 | 温度 | 时间 | 压强 | 残液颜色 |
a | 110 | 60 |
| 浅蓝色 |
b | 100 | 40 |
| 几乎很浅 |
c | 90 | 30 |
| 无色透明 |
由表中信息可知蒸氨的条件应选________![]() 填序号
填序号![]() 。
。
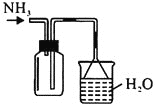
蒸出的氨气可以回收利用,在实验室用如图装置来收集。当集气瓶收集满氨气时观察到的现象是________。
(4)反应Ⅱ的离子方程式为________。
【题目】(1)CO(NH2)2分子中含有σ键与π键的数目之比为:______,N原子的杂化类型为______。
(2)类卤素(SCN)2与卤素性质相似,对应的酸有两种,理论上硫氰酸(HSC≡N)的沸点低于异硫氰酸(HN=C=S)的沸点,其原因是:_________________________。
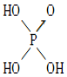
(3)S能形成很多种含氧酸根离子,如SO32-、SO42-、S2O72-,已知S2O72-的结构中所有原子都达到稳定结构,且不存在非极性键,由该离子组成二元酸的分子式为H2S2O7,试写出其结构式_____________________________。
(4)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:含氧酸酸性强弱与非羟基氧原子数的关系。
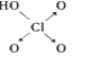
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
已知亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,
则H3PO3与过量的NaOH溶液反应的化学方程式是:__________________________,
在H3AsO3中加入足量的浓盐酸,写出化学方程式:___________________________。
【题目】常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是
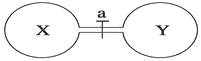
编号 | ① | ② | ③ | ④ |
气体X | HI | NH3 | H2 | NO |
气体Y | Cl2 | HCl | Cl2 | O2 |
A. ②>③>①>④ B. ③>①=④>②
C. ③>①>④>② D. ④>①>②>③