题目内容
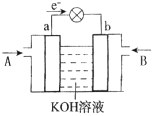
【题目】在下图所示的装置中,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极质量增大,则以下叙述正确的是
A. a为正极,是碳棒,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. 外电路的电子流向为:b→外电路→a
D. 溶液中阳离子向a 极移动,且a极上发生的是氧化反应
【答案】BC
【解析】
两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极质量增大,说明该装置构成了原电池,其中a极是正极,根据原电池的工作原理和规律来回答。
A.a极上质量增大,说明a是正极,应该是碳棒,负极b是铁片,烧杯中的溶液可以为不活泼金属的硫酸盐,不能是硫酸,A错误;
B.a极上质量增加,说明a是正极,应该是碳棒,负极b是铁片,烧杯中的溶液可以为不活泼金属的硫酸铜溶液,正极上会析出金属铜,B正确;
C.外电路的电子由负极经外电路到正极,由于该原电池a为正极,b为负极,所以电子流向为:b→外电路→a ,C正确;
D. a极上质量增加,说明a是正极,b为负极,溶液中的阳离子向正极a极移动,且a极上得到电子,发生的是还原反应,而不是氧化反应,D错误;
故合理选项是BC。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,体系中n(CO)随时间的变化如下表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示CH3OH的变化的曲线是_______。

(2)用H2表示从0~2s内该反应的平均速率v(H2)=___________________。
(3)该反应达到最大限度时CO的转化率为___________。
(提示:转化率=![]() ×100%)
×100%)
(4)能说明该反应已达到平衡状态的是______。
a. CO与H2的浓度保持不变 b. 容器内密度保持不变
c. 容器内压强保持不变 d. 每消耗1molCH3OH的同时有2mol H–H形成
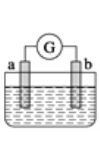
(5)CH3OH与O2的反应可将化学能转化为电能,其工作原理如下图所示,图中CH3OH从______(填A或B)通入。