题目内容
【题目】A、B、C、D、E均为易溶于水的化合物,其离子组成如下表。(各化合物中离子组成不重复)
阳离子 | Na+、Al3+、Ag+、Ba2+、Fe3+ |
阴离子 | Cl-、CO32-、SO42-、NO3-、OH- |
分别取溶液进行如下实验:
①用pH试纸分别测得B、C溶液均呈碱性,且0.1 molL B溶液pH>13;
②D溶液加入铜粉,溶液质量增加;
③在E溶液中逐滴滴入B至过量,先生成白色沉淀,后沉淀完全溶解;
④在A溶液中逐滴滴入氨水至过量,先生成白色沉淀,后沉淀完全溶解。
请回答下列问题:
(1)B的名称;_______________,E的名称;______________。
(2)C水溶液呈碱性原因:_____________(用离子方程式表示);0.1mol/L的C溶液中和0.1mol/L的NaHCO3溶液中,阴离子的总数:C溶液___________NaHCO3溶液。(填“>”或 “<”)
(3)D溶液呈________(填“酸性”“碱性”或“中性”)。若将D溶液加热蒸干得到固体应是__________(填化学式)。若将E溶液加热蒸干后再高温灼烧得到固体应是___________ (填化学式)。
【答案】 氢氧化钡 氯化铝 CO32-+H2O![]() HCO3-+OH- > 酸性 Fe2(SO4)3 A12O3
HCO3-+OH- > 酸性 Fe2(SO4)3 A12O3
【解析】由己知离子组成的易溶于水的化合物中,显碱性的有NaCO3、Ba(OH)2、NaOH,其中0.1 mol/L,Ba(OH)2溶液的pH>13,又由于各化合物中离子组成不重复,故实验①可以确定B为Ba(OH)2,C为Na2CO3;由银氨溶液的制备可知实验④中的A为AgNO3;结合以上分析及实验②可知D为FeCl3或Fe2(SO4)3;再由实验③可知E为氯化物,故D只能是Fe2(SO4)3,则E为AlCl3。(1)B为氢氧化钡;E为氯化铝;(2)碳酸钠溶液显碱性是CO水解的缘故;0.1 mol/L的碳酸钠溶液中阴离子总数比0.1 mol/L的碳酸氢钠溶液中阴离子总数大;(3)D为Fe2(SO4)3,Fe3+水解显酸性;加热硫酸铁溶液促进Fe3+的水解,但硫酸为高沸点物质,不能挥发,加热蒸干得到的还是硫酸铁固体。

 阅读快车系列答案
阅读快车系列答案【题目】无色溶液中含有:①Na+、②Ba2+、③Cl-、④Br-、⑤SO![]() 、⑥SO
、⑥SO![]() 、⑦Fe2+离子中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
、⑦Fe2+离子中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤 | 操作 | 现象 |
① | 用pH试纸检验 | 溶液的pH大于7 |
② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙红色 |
③ | 取②的上层溶液,加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
根据上述实验现象,判断以下结论中正确的是( )
A. 肯定含有的离子是①④⑤ B. 肯定没有的离子是②⑤⑦
C. 可能含有的离子是①②⑥ D. 不能确定的离子是①③⑥
【题目】某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。
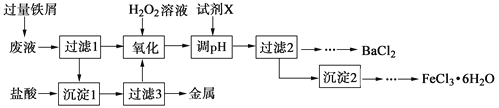
(1)沉淀1中含有的金属单质是 。
(2)氧化时加入H2O2溶液发生反应的离子方程式为 。
(3)下列物质中,可以作为试剂X的是 (填字母)。
A.BaCl2 | B.BaCO3 | C.NaOH | D.Ba(OH)2 |
(4)检验沉淀2洗涤是否完全的方法是 。
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 。
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为 、冷却结晶、 、洗涤、干燥。




