��Ŀ����
����Ŀ������������Ũ�����ܽ�ľ̿��������CO2 �� ��������ԭ��SO2��������ͼ���и�װ�����һ��ʵ�飬����֤������Ӧ�������ĸ��ֲ��
��1����Щװ�õ�����˳���ǣ������������������ҵķ�����дװ�õı�ţ�����������
��2��ʵ��ʱ�ɹ۲쵽װ�â���Aƿ����Һ��ɫ��Aƿ��Һ�������� �� Bƿ��Һ�������� �� Cƿ��Һ����������д��B�з��������ӷ���ʽ��
��3��װ�â������ӵĹ���ҩƷ�� �� ����֤�IJ�������
��4��װ�â�����ʢ��Һ�� �� ����֤�IJ�������
���𰸡�
��1���ܣ��ڣ��٣���
��2�������������ȥ������������������Ƿ���ڣ���ֹ���Ŷ�����̼���飻5SO2+ 2MnO4-+2H2O= 5SO42- +2Mn2++4H+
��3����ˮ����ͭ��ˮ
��4������ʯ��ˮ��CO2
����������1��������̼�Ͷ���������ʹ����ʯ��ˮ����ǣ������������ܱ����Ը��������Һ������ʹ���Ը��������Һ��ɫ����ʹƷ����Һ��ɫ������Ư���ԣ���������̼û�д����ʣ����Լ��������̼֮ǰ�ȼ����������ˮ��������ˮ����ͭ���飬��������˳���ǣ������Ʊ���ˮ�����������������������ȥ���������������������������̼���飬����������˳���Ǣܡ��ڡ��١��ۣ�
��2��ʵ��ʱ�ɹ۲쵽װ�â���Aƿ����Һ��ɫcƿ����Һ����ɫ��˵��ͨ��cƿ�������в�����������A�������Ǽ��������������Ʒ����Һ��ɫ�������������������л�ԭ�ԡ����Ը�����ؾ���ǿ�����ԣ����߷���������ԭ��Ӧ��ʹ���Ը��������Һ��ɫ������B�������dz�ȥ��������C�������Ǽ�����������Ƿ���ڣ���ֹ���Ŷ�����̼���飻B��SO2ʹ���Ը��������Һ��ɫ��������Ӧ�����ӷ���ʽΪ5SO2+ 2MnO4-+2H2O= 5SO42- +2Mn2++4H+��
��3��ˮ������ʹ��ˮ����ͭ����ɫ��Ϊ��ɫ����������ˮ����ͭ����ˮ����������װ�â�����װ�Ĺ���ҩƷ����ˮ����ͭ������֤�IJ�����ˮ��
��4��������̼��ʹ����ʯ��ˮ����ǣ�����ʵ�����ó���ʯ��ˮ���������̼����װ�â�����ʢ��Һ�dz���ʯ��ˮ��

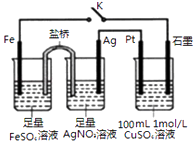
����Ŀ����֪�����������������·�Ӧ��ϵ��KBrO3�ܽ�KI������I2�� Br2�ܽ�I������ΪI2 �� IO3��Ҳ�ܽ�Br������ΪBr2 �� �䱾������ԭΪI2 �� ������1mol KI��������Һ�м��뺬amol KBrO3��Һ��a��ȡֵ��ͬ�����ò���Ҳ��ͬ�������ж���ȷ�ǣ� ��
��� | a��ȡֵ��Χ | ����Ļ�ѧʽ�������ӷ��ţ� |
�� | a�� | I2Br�� |
�� |
| I2Br��Br2 |
�� |
| I2 IO3�� Br2 |
�� | a�� | IO3�� Br2 |
A.�٢ۢ�
B.�ڢۢ�
C.�٢ڢۢ�
D.�٢�