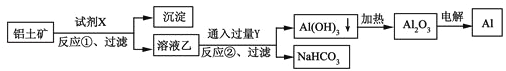
��Ŀ����
����Ŀ��ijѧϰС���ͬѧ�����õ⻯������̼�����Ƶķ�Ӧ���Ʊ��ߴ��ȵĵ⻯�ƾ��壮�ش��������⣺
��1���⻯������Һ���Ʊ�����������۰����ʵ���֮���� ![]() ��
�� ![]() ֮�����ϣ�����������ƿ�У���ͼ����Ȼ���������ˮ������װ���г���ͨ��N2 �� ��40��60���½��跴Ӧ30��50min������Ӧ��ɼ������ӦҺ�в����ⵥ�ʺ��˼��Ƶõ⻯������Һ�� �����������۹�����Ŀ����������ͨ��N2��Ŀ���� ��
֮�����ϣ�����������ƿ�У���ͼ����Ȼ���������ˮ������װ���г���ͨ��N2 �� ��40��60���½��跴Ӧ30��50min������Ӧ��ɼ������ӦҺ�в����ⵥ�ʺ��˼��Ƶõ⻯������Һ�� �����������۹�����Ŀ����������ͨ��N2��Ŀ���� ��
�ڼ��鷴ӦҺ�в����ⵥ�ʵķ����� ��
��2���⻯����Һ���Ʊ������Ʊ��õĵ⻯������Һ����̼��������Һ�У����Ƶ⻯������̼�����Ƶ����ʵ���֮���� ![]() ��
�� ![]() ����80��100���£���Ӧ30��50min����Ӧ���ɵ⻯�Ƽ����������ȣ��÷�Ӧ�Ļ�ѧ����ʽΪ ��
����80��100���£���Ӧ30��50min����Ӧ���ɵ⻯�Ƽ����������ȣ��÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3���㻯�Ƶ��ᴿ��ᾧ�� �ٳ�ȥ�⻯����Һ����HCO3���ķ����� ��
�ڴӵ⻯����Һ�л�õ⻯�ƾ��壨20��ʱ�ܽ��Ϊ179/100gˮ��100��ʱ�ܽ��Ϊ302/100gˮ���IJ��������� ��
��4���⻯�Ƶ���ȵIJⶨ�� ��С��ͬѧ��ȡ�Ƶõĵ⻯�ƾ���18.1g������ˮ�����50mL2.5mol/LAgNO3��Һ�����ˡ�ϴ�ӡ�����Ƶó���������Ϊ28.2g����⻯�ƾ���Ĵ���Ϊ �� �����ʲ����뷴Ӧ�����������С�������λ��
���𰸡�
��1��ʹ���ַ�Ӧ������������ʣ���ֹ���ɵ�I����������ȡ������Һ���Թ��У����˵�����Һ��������ϡ���ᣩ����Һ������ɫ��˵���Ѳ���I2
��2��FeI2+2NaHCO3=FeCO3��+2NaI+CO2��+H2O
��3����2������Һ�м����Թ�����HI��Һ�����ȣ�����Ũ����������־�Ĥ����ȴ�ᾧ������
��4��99.45%
���������⣺��1�����Ʊ��⻯������Һ��Ϊ��֤���ַ�Ӧ�����۹�������Ӧ����ͨ�뵪������ֹ��ֹ���ɵ�I���������� ���Դ��ǣ�ʹ���ַ�Ӧ������������ʣ���ֹ���ɵ�I����������
�ڼ��鷴ӦҺ�в����ⵥ�ʿ�ѡ���ۣ��ʷ����ǣ�ȡ������Һ���Թ��У����˵�����Һ��������ϡ���ᣩ����Һ������ɫ��˵���Ѳ���I2��
���Դ��ǣ�ȡ������Һ���Թ��У����˵�����Һ��������ϡ���ᣩ����Һ������ɫ��˵���Ѳ���I2����2�����Ʊ��õĵ⻯������Һ����̼��������Һ�У���80��100���£����ɵ⻯�Ƽ�̼�������Ͷ�����̼����ѧ����ʽΪ��FeI2+2NaHCO3=FeCO3��+2NaI+CO2��+H2O��
���Դ��ǣ�FeI2+2NaHCO3=FeCO3��+2NaI+CO2��+H2O����3���ٳ�ȥ�⻯����Һ�е�HCO3�����ʵ���ǿ��Һ���ԣ�ͬʱע�ⲻ�������ʣ�����Ϊ����2������Һ�м����Թ�����HI��Һ�����ȣ�
���Դ��ǣ���2������Һ�м����Թ�����HI��Һ�����ȣ��ڵ⻯��20��ʱ�ܽ��Ϊ179/100gˮ��100��ʱ�ܽ��Ϊ302/100gˮ�����⻯����Һ����Ũ����������־�Ĥ����ȴ�ᾧ�����
���Դ��ǣ�����Ũ����������־�Ĥ����ȴ�ᾧ�������4������NaI��AgI����m��NaI��= ![]() g=18g���ʴ���Ϊ��
g=18g���ʴ���Ϊ�� ![]() =99.45%��
=99.45%��
���Դ��ǣ�99.45%��

����Ŀ����2L�ܱ������ڣ�800��ʱ��Ӧ��2NO��g��+O2��g��2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 |
n��NO����mol�� | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K=���������������䣬���������СΪ1L����Kֵ �� ������С�䣩����K300��C��K350��C �� ��÷�Ӧ���ȷ�Ӧ��
��2����O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v=��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����
a��v��NO2��=2v��O2��
b��������ѹǿ���ֲ���
c��v����NO��=2v����O2��
d���������ܶȱ��ֲ���
��4��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����
a����ʱ�����NO2����
b���ʵ������¶�
c������O2��Ũ��
d��ѡ���Ч������
����Ŀ����֪��ӦA��s��+B��g��C��g��+D��g���Ļ�ѧƽ�ⳣ�����¶ȵĹ�ϵ�����
�¶�/�� | 700 | 800 | 830 | 1 000 | 1 200 |
��ѧƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
����˵����ȷ���ǣ� ��
A.�÷�ӦΪ���ȷ�Ӧ
B.�÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK= ![]()
C.������������ʱ��������ϵ��ѹǿ����ѧƽ�ⳣ����С
D.��λʱ��������B��D�����ʵ������ʱ���÷�Ӧ����ƽ��״̬